
在反相色谱中,提高柱温通常会降低分析物的保留。在一个没有控制柱温的方法中,如果实验环境温度发生了变化,会出现什么问题?
在早期的液相色谱中,精准控制色谱柱温度并不是许多仪器设置中的首要考虑因素。不像气相色谱,柱温是决定保留的最重要的实验变量,在液相色谱中,柱温对于保留的影响相对流动相的组成来说要弱很多(也就是说,反相、亲水色谱HILIC中有机相和水相的比例,或基于电荷分离方法中阴离子和阳离子浓度的比例对于分析物保留的影响重要的多)。
随着大家对液相色谱中温度影响的认识在不断提高,例如,进一步了解了柱温对于不同类型分析物保留的影响(1),色谱柱入口处流动相温度与色谱柱温度匹配的重要性(2),以及色谱柱中热流对柱效的影响(3),精准控制液相色谱柱温度的需求也在不断的增加。越来越多的色谱工作者已经开始注意控制液相色谱仪的温度(仪器厂家也早已设计出了相应的仪器模块),并且在开发和验证方法的时候习惯明确规定一个温度值或者温度范围。然而,现在还是有很多在用的方法上标明的是“室温”条件,而且大多时候方法中所指的“室温”并没有一个明确的定义。这样就产生了一个很明显的问题:类似这样的方法,我们能否合理预期在阿拉斯加的安克雷奇和在印度的孟买能得到相同的分离效果?
在这期“液相色谱常见问题处理”中,我们将会讨论液相色谱中温度对化合物保留的影响的原理,并且以一些实验数据来帮助我们理解如果允许“室温”条件发生一些变化,将在什么情况下会严重影响化合物的分离。
反相液相色谱中柱温对于化合物保留影响的原理
在反相液相色谱中,柱温对化合物保留的影响通常可以通过Van’t Hoff定律来进行描述,如下所列的方程1:
k是分析物的保留因子,T是在这个k值下的温度。变量A是一个特定条件下参数,与分析物从流动相到固定相之间熵的传递和相比(固定相体积和流动相体积的关系)有关,变量B则与分析物从流动相到固定相之间焓的传递有关。图1显示了在C18色谱柱,乙腈水为流动相的条件下,几个中性小分子化合物在不同的温度下的保留数据。数据大致呈线性变化的趋势,如方程1所预测的一致。Weber团队通过大量的实验数据对此进行验证,得出结论是方程式1的非线性版本比线性版本能更好的贴合实验数据(1)。还有其他研究人员则提出了争议,认为数据呈现线性的表象更趋向于是一种巧合,而不是热力学的必然性。

图1. 几个中性小分子化合物在C18色谱柱,乙腈水(50/50)作为流动相的条件下,柱温(T)的变化对保留因子(k)的影响:(a)为甲苯,乙苯和丙苯;(b)为对硝基氯苄和苯甲醚。虚线为线性回归线。数据来源于Yun Mao的博士学位论文(6)。
图1中各直线的斜率与分析物从流动相到固定相之间焓的传递有关。对于化学结构类似的分子而言,这些斜率的数值相似,如图1a中的甲苯,乙苯和丙苯所示数据。对于这些结构类似化合物的分离,提高柱温能够减少分析物的保留,而不会对各峰之间的间距(也就是说选择性)产生太大的变化,因为所有的峰都是以差不多相同的速率朝一个方向移动。然而,对于一些带有不同官能团的化合物,斜率则会差异很大,如图1b中的对硝基氯苄和苯甲醚。在这类实例中,提高柱温会减少分析物的保留,但由于变化速率不同,因此选择性和分离度将会发生变化。极端的例子表明甚至还能导致洗脱顺序发生变化(5)。大家若有兴趣,可以简单通过下面网站提供的模拟装置进行尝试,在上面可以通过改变流动相组成和色谱柱温度,然后观察对保留和分离的影响(www.multidlc.org/hplcsim)。
让我们来看看一些实验的数据
在准备写这期“液相色谱常见问题处理”的时候,我给我们实验室的一台液相色谱仪制造了一个微环境。首先断开色谱柱常用的柱温箱,然后对微环境进行加温或者降温,来模拟“室温”的变化对于分离的影响,并且利用一个小热电偶来测量色谱柱入口处附近环境的温度。最后,我记录了几款简单化合物(一个酸性,一个碱性,两个中性化合物)在不同“室温”条件下的色谱图,每个温度下系统都平衡了30分钟。图2为24、28和42 ℃三个“室温”条件下的色谱图。添加垂直虚线作为视觉辅助,有助于观察随着温度的升高保留的变化。
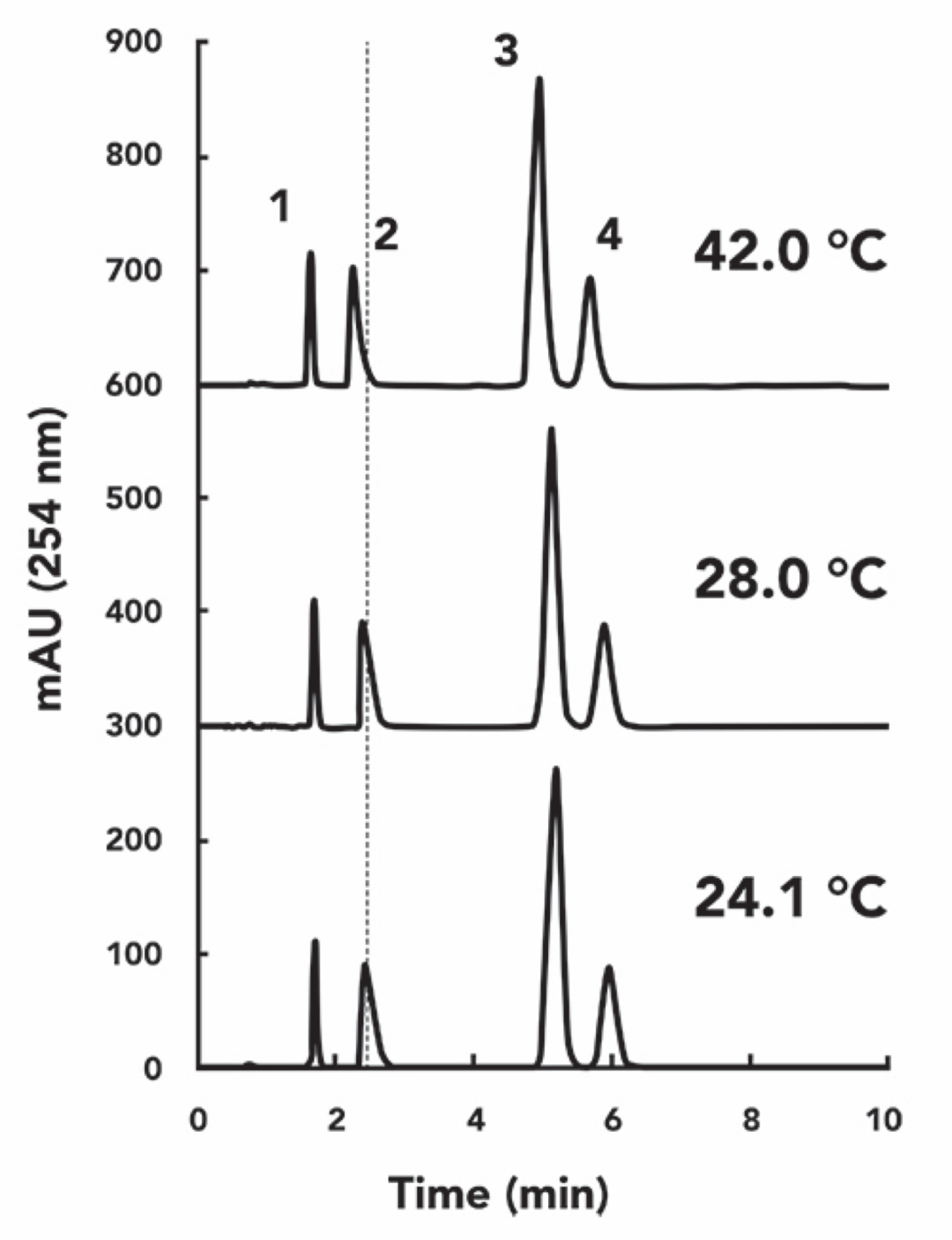
图2:测试物在不同温度下的色谱图。添加垂直虚线作为视觉辅助,助于对比保留时间。
条件:色谱柱50 mm x 4.6-mm i.d., Zorbax SB-C18 (5-µm);流速1.0 ml/min;流动相,乙腈:甲酸铵水溶液(25mM铵盐/氨水,105mM甲酸/甲酸盐,pH3.2)40:60(v/v),进样量2 μL。测试化合物1)苯乙酮,2)去甲替林,3)苯丁酮,4)丁基苯甲酸
尽管这些变化肉眼可见,然而根据数据结果绘制出与温度的函数关系能更准确的了解这种影响,尤其是选择性的变化。图3清晰的表明了温度对这四种目标化合物保留的影响。在图3a中,我绘制出了各温度下保留因子的绝对值,在图3b中,则绘制出了在测量温度范围内的每种化合物保留因子与平均保留因子比值的百分比变化。果不其然,所有化合物的保留都随着温度的升高而减少,这是我们通过这个实验得出的第一个要点。“室温”的变化肯定能引起小分子化合物的保留发生大约2%的变化。在42 ℃下的数据诚然有点极端,甚至超出了美国实验室室温条件下的适用范围,但是对于全球的液相色谱实验室来说是有必要的。
在图3b中,我们发现除了去甲替林曲线斜率更陡之外,其他曲线斜率的变化趋势(k值变化的百分比与温度T)基本一致。就像先前讨论过的,如果所有化合物的保留随着温度变化以相同的速率发生同样的变化,这种情况下,温度的设置对于方法的执行不会产生太大的问题,因为不会对分离度有什么影响。然而,图3b中去甲替林保留变化的速率高出了其他化合物大约两倍。

图3:待测化合物在测试温度范围内(21-42 ℃)保留因子(a)和保留因子百分比(b)的变化
通过绘制出选择因子与温度的变化曲线,我们能更准确的看到相对保留上的这些变化。图4a为不同温度下几对目标化合物的选择因子α值,图4b为选择因子α值变化百分比随温度的变化关系。我们发现,当温度从24 ℃升高到42 ℃,中性化合物(苯乙酮和苯丁酮)的选择性没有发生明显的变化。甚至苯丁酮和丁基苯甲酸的选择性也没有发生明显变化,尽管他们的化学性质截然不同。即使丁基苯甲酸可电离,但在pH3.2条件下绝大多数还是呈中性状态。另一方面,我们发现在所研究的温度范围内,去甲替林的选择因子的变化非常大。去甲替林与苯丁酮(红圈)或丁基苯甲酸(蓝圈)的α选择因子比值变化接近5%。

图4:待测化合物在测试室温范围内(21-42 ℃)选择因子(a)和选择因子百分比(b)的变化
对方法开发和执行可能造成的影响
到目前为止,我们观察到温度的变化可能对一些,但不是全部,类型的化合物在反相色谱分离上的选择性产生明显的影响。在实际应用中很重要的问题是:在什么情况下这些变化会变得很重要?我所研究的几个化合物分离的很好(图2),即使5%选择性的变化也不会导致它们达不到基线分离。然而,实际应用中碰到的情况并不都是这样。例如,在一个室温条件下勉强达到分离的两个相邻的峰,当换到另外一个室温条件时,则可能会对这两个峰的分离造成很大影响。我们可以通过Purnell方程(方程2)来定量这种影响。
我们假设柱效(N)为15000,两个峰其中后出峰的保留因子(k)为5,选择因子α为1.1,则两个峰之间的分离度(Rs)则大约为2.3。我们可以通过方程2计算出选择因子的变化对分离的影响。图5中显示了当α值减少5%时(从1.1降低至1.045),分离度是如何降低的。分离度2.3意味着两个峰分离度良好,达到了基线分离,然而分离度1.1则意味着两个峰之间有部分重叠。重叠的峰则会严重影响方法的准确定量,尤其是当两个物质中一个物质的浓度远高于另外一个的时候。

图5:选择性α的降低对两个相邻峰的分离度的影响。分离度通过Purnell方程(方程2)计算得出,假设N=15000,k=5,初始α=1.1
结论:
在这期“液相色谱常见问题处理”中,我们验证了在没控制柱温的情况下,室温的变化对于反相液相色谱分析性能的影响。在绝大多数的实例中显示,增加温度会导致反相色谱保留减弱。只要温度的变化对相邻两个峰保留变化的影响都差不多,则不会对这两个峰的分离有什么影响。然而,这并不能代表所有的情况,有时分离的选择性发生大约百分之几的明显变化。而这些选择性的变化会反过来导致相邻峰之间分离度发生明显的减少(或增加),而这些分离度的变化大约能达到50%!
总的来说,这意味着:
在方法开发的过程中明确规定“室温”的条件,将有利于避免在方法执行的过程中出现问题,尤其是该方法需要到各个不同环境的实验室去得到执行,而这些实验室所处的室温环境各不相同。
在方法开发的过程中,柱温变化对方法影响的敏感程度,需要被列入方法稳定性的考察之中。
用恒温箱来控制色谱柱的柱温能够避免上述所有问题的发生,尽管是以增加了一个仪器模块作为代价。
May 01, 2020
By Dwight R. Stoll
LCGC North America Volume 38, Issue 5, pg 261–268
参考文献
A.R. Horner, R.E. Wilson, S.R. Groskreutz, B.E. Murray, and S.G. Weber, J. Chromatogr A 1589, 73–82 (2019). https://doi.org/10.1016/j.chroma.2018.12.055.
J.D. Thompson, J.S. Brown, and P.W. Carr, Anal. Chem.73, 3340–3347(2001). https://doi.org/10.1021/ac010091y.
F. Gritti, LCGC North Am.36(6s), 18–23 (2018).
F. Gritti and G. Guiochon, Anal. Chem.78, 4642–4653(2006). https://doi.org/10.1021/ac0602017.
Y. Mao and P.W. Carr, Anal. Chem. 72, 110–118(2000). https://doi.org/10.1021/ac990638x.
Y. Mao, Selectivity Optimization in Liquid Chromatography Using the Thermally Tuned Tandem Column (T3C) Concept, Ph.D. Dissertation, University of Minnesota, 2001.
文章来源:网络
免责声明:本公众号所载文章版权归原作者所有。转载文章旨在知识分享,如涉及作品内容、版权和其它问题,请联系我们删除!文章内容为作者个人观点,并不代表本公众号赞同或支持其观点。本公众号拥有对此声明的最终解释权。