
景杰学术 | 报道
KRAS突变是人类恶性肿瘤中突变率最高、最难靶向治疗的肿瘤类型之一。之所以难以有效的治疗,除了KRAS蛋白自身难以被靶向外,非常关键的原因是虽然不同肿瘤均含KRAS突变,但此类肿瘤具有高度异质性,其下游的磷酸化信号通路相互代偿和反馈性调节显示出极大的差异,因此直接上下游通路的药物干预基本无效 [1]。
蛋白质组和磷酸化组学分析无疑是对于理解异质性和信号通路代偿这个关键问题的最直接方案。以往的研究主要聚焦于基因组层面,且大多针对的是单一组织来源的肿瘤样本[2],离揭示出完整的KRAS突变肿瘤异质性还有很大距离。
近日,国际专业学术期刊Molecular Cell发表了题为“A proteomic and phosphoproteomic landscape of KRAS mutant cancers identifies combination therapies”的研究长文。来自中国科学院上海药物研究所的谭敏佳和黄敏团队合作通过大规模的整合分析蛋白质组、磷酸化组学数据和药敏数据,对KRAS突变肿瘤进行进一步精确分子分型,并且针对性地分析挖掘基于“磷酸化信号通路互补”的联合用药策略,实现分子亚型的精准治疗。

Graphical abstract
01
KRAS突变细胞系的蛋白质组学和磷酸化修饰组学分析和亚型整合
研究人员对不同组织来源的43株KRAS突变肿瘤细胞系(包括胰腺癌、非小细胞肺癌、结直肠腺癌等)(样本策略)进行了系统的蛋白质组学和磷酸化修饰组学分析(质谱策略),得到>14,500种蛋白质,>5,600种磷酸化蛋白质和>19,700种磷酸化肽(图1 A-C)。为了全面了解KRAS突变癌症的分子异质性,研究人员将得到的蛋白质组学和磷酸化修饰组学数据与来自癌症药物敏感性基因组学 (GDSC) 公共数据库相整合,将KRAS突变细胞株划分为三个具有不同生物学特征的亚型S1,S2和S3(图1 E)。

图1 KRAS突变细胞系的整合磷酸化修饰组学分析
02
多组学分析揭示了KRAS突变亚型的不同分子特征
为了鉴别这些亚型中最具辨别力的分子特征,研究人员利用随机森林进行特征分子的筛选,分别鉴定了16种蛋白质、8种磷酸化蛋白质以及21种 mRNA作为蛋白质、磷酸化蛋白质和mRNA水平的亚型特征(图2 B)。通过对TCGA数据库中KRAS突变样本进行分析,得到与细胞系中的表达基本相似的分子特征,聚类分析也得到相似的三个亚型(T1、T2和T3)。为了探索不同亚型特征的潜在效用,研究人员比较了三个亚型的预后和肿瘤驱动基因的突变频率,结果显示三者存在显著差异,T2和S2显示最差的预后和最低的驱动基因的突变频率,而T3显示出最好的预后和最高的驱动基因的突变频率(图2 C)。这些结果表明分子分型与KRAS突变肿瘤患者预后密切相关,具有极大的临床研究价值。
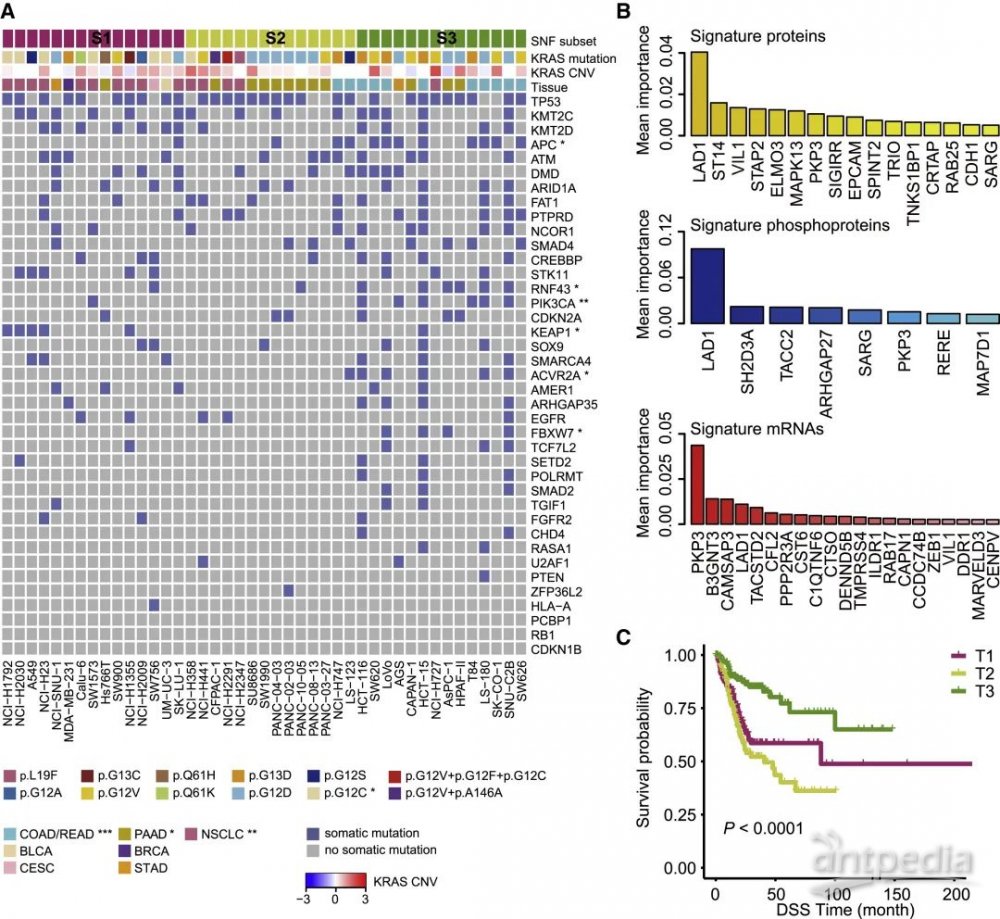
图2 KRAS突变亚型的不同分子特征
GSEA分析结果显示,与S1和S3相比,S2表现出更多的癌基因通路被显著激活(图3 A和B),这可能解释了驱动基因突变频率最低的T2患者具有最差临床预后结果。进一步分析得到,S1显示了在mRNA水平上与细胞周期相关通路的富集,以及mRNA和蛋白质水平的EMT和MYC通路的富集;S2显示了KRAS和炎症反应途径的富集;而S3中富集的标志性通路较少,这可能部分解释了S3患者的最佳预后。
为了识别特定亚型磷酸化的功能,研究人员从PhosphoSitePlus数据库中检索了所有功能注释的磷酸化位点。结果显示,与S3相比,S1和S2参与凋亡抑制、细胞生长和细胞运动的磷位点水平较高,而参与凋亡诱导、细胞分化和转录抑制的磷位点水平较低(图3 D),这一结果可以部分解释三个亚型之间差异激活的信号通路。进一步分析RTK/RAS信号通路的蛋白质和磷酸化水平,研究人员发现在S2中MET和MAPK通路的蛋白质和磷酸化水平均显着上调(图3 E)。这些结果说明差异表达/激活的RTK通路分子可能会导致KRAS突变癌症的异质表型,有望作为治疗靶点进行深入地探索。
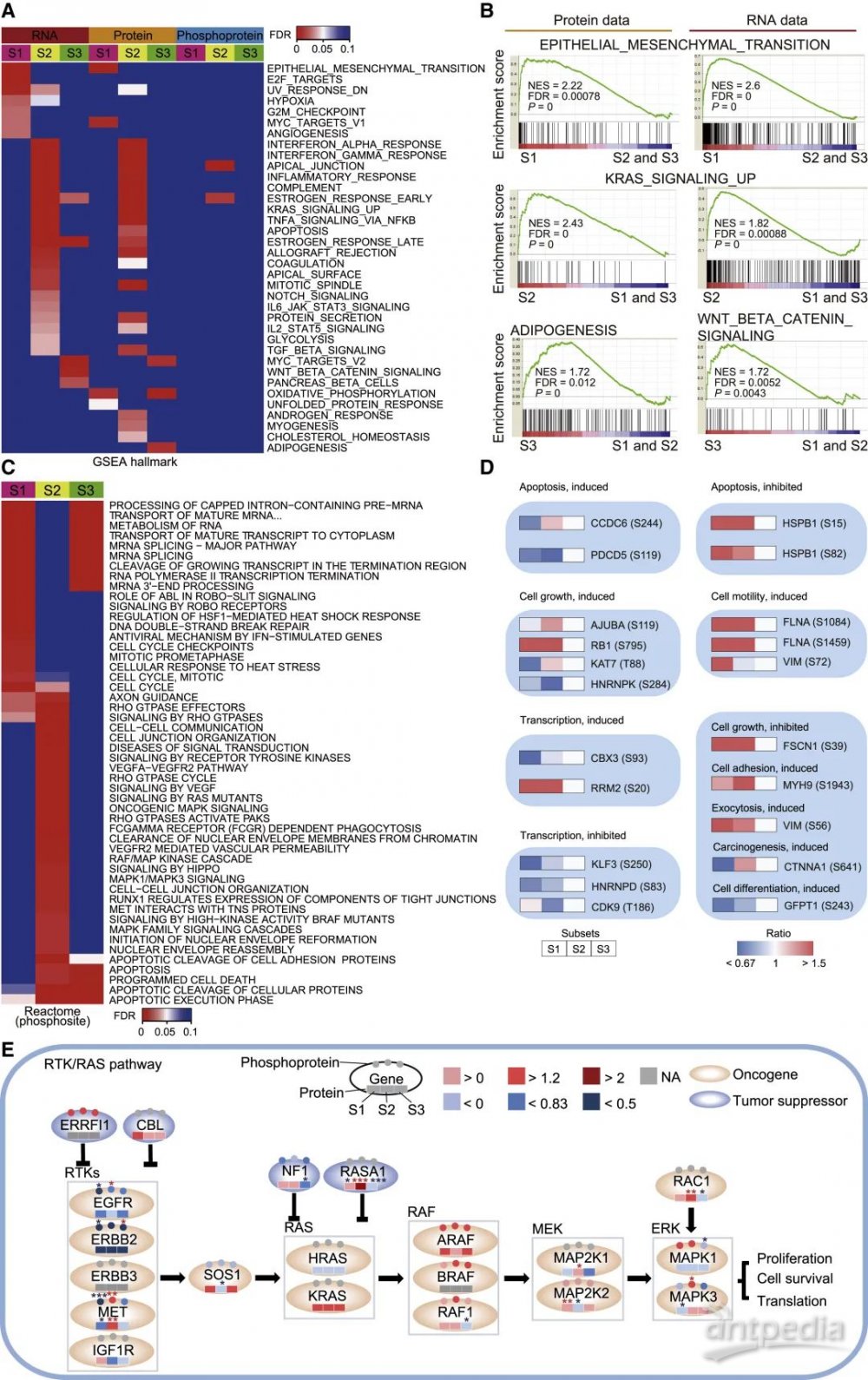
图3 GSEA分析结果
03
磷酸化修饰组学揭示抗肿瘤作用的药物联用组合
在精准分型的基础上,研究人员通过分析药敏数据库(GDSC)和肿瘤细胞株基因依赖性数据库(DepMap),深入探索了KRAS突变肿瘤的潜在治疗靶标、治疗药物及药效生物标志物。通过蛋白磷酸化修饰组学和药敏数据的相关性整合分析,研究人员首次提出了基于“磷酸化信号通路互补策略”的联合用药预测方法,经过筛选,最终确定了41种药物组合(图4 A)。在这些组合中,所有药物组合在S2中均通过了共激活分析,在S3中通过了五种药物组合,而在S1中没有组合通过,这些结果很可能是因为亚型之间的磷酸化水平不同导致的。此外,研究人员还验证了一系列具有协同抗肿瘤作用的药物联用组合(图4 B)。

图4 磷酸化修饰组学揭示抗肿瘤作用的药物联用组合
04
DOT1Li联合SHP2i协同治疗KRAS突变肿瘤机制的挖掘
进一步地,研究人员选取了在当前抗肿瘤新药研发领域备受关注的两个靶标组合,即组蛋白甲基转移酶DOT1L和磷酸酶SHP2。通过细胞实验和小鼠体内成瘤实验,证实了DOT1L联合SHP2抑制剂能协同治疗KRAS突变肿瘤,特别是对恶性程度最高的肿瘤S2亚型效果显著(图4 C-G)。为了探究二者协同抗肿瘤的机制,研究人员利用蛋白质组学、RNA-seq和(ChIP)-qPCR数据进行分析(图5),发现DOT1L的抑制可以引起组蛋白H3K27甲基化向乙酰化修饰的转变,从而促进了PREX1的转录,进而反馈性上调了MAPK/AKT通路,使得原本对SHP2抑制剂不敏感的KRAS突变肿瘤对该类抑制剂的敏感性增强,从而实现了协同抗肿瘤。
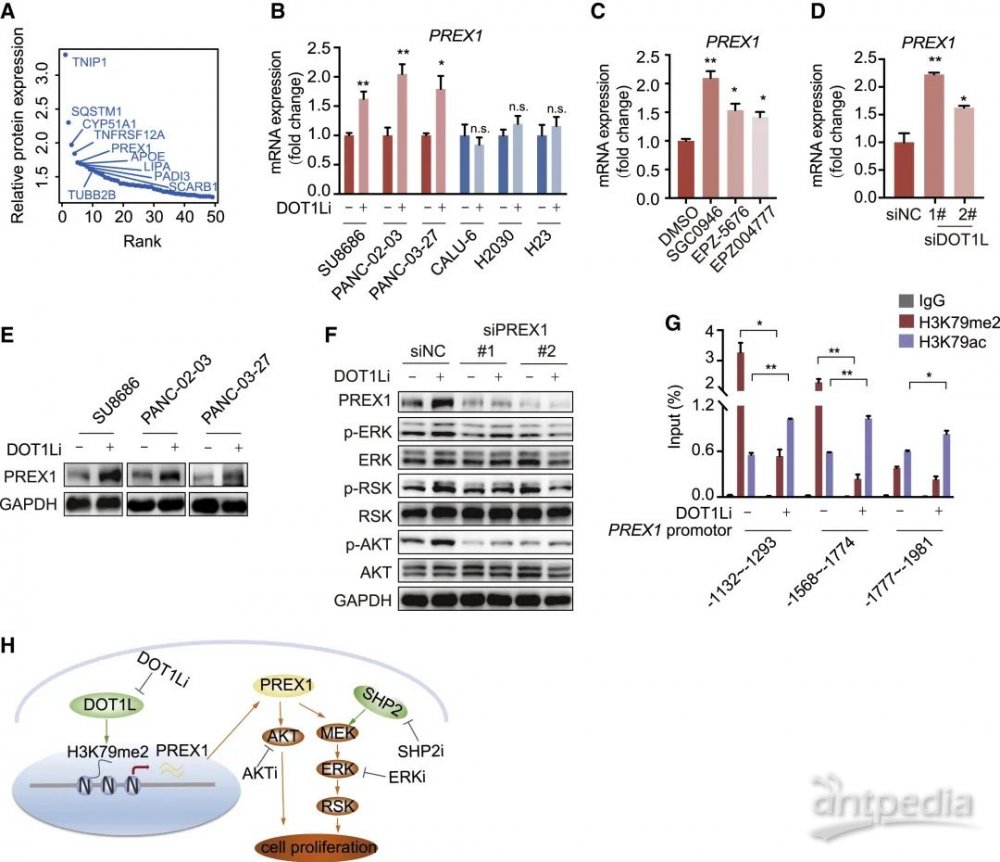
图5 DOT1Li联合SHP2i协同治疗KRAS突变肿瘤机制
总之,该研究通过对大规模基因组-蛋白质组-磷酸化修饰组学数据的整合分析,揭示了KRAS突变肿瘤在蛋白质组和磷酸化组层面的分子特征,发现基于“磷酸化信号通路互补”的联合用药新策略,使得KRAS突变肿瘤的个性化治疗成为可能,有望实现分子亚型的精准治疗。
值得一提的是,该研究为蛋白基因组学研究(proteogenomics)提供了一个新的方向和范例。整合蛋白质组学及修饰组学技术与数据,将其和驱动基因(如KRAS突变等)联系起来,结合药敏、预后的验证,探索联合用药的新策略,最终实现分子分型和精准治疗。也再次表明了基于质谱的蛋白质组学及修饰蛋白质组学研究在精准医学研究中的核心价值。
更多阅读
Cell|再添成果!蛋白组学研究发现肺鳞状细胞癌治疗的新靶点
2021-08-10

Dev Cell | 空间蛋白组和磷酸化修饰组联合揭示肝脏内皮细胞全景
2021-07-02

Nature | 单细胞蛋白质组学揭示细胞周期时空蛋白图谱
2021-06-18

Cell Reports|蛋白质组学揭示HDAC抑制剂的全局性调控机制
2021-05-17

Cell重磅发布!磷酸化修饰组学揭示COVID-19介导的心脏损害
2021-05-14

更高深度,磷酸化修饰组+蛋白组双重升级
2021-05-08

参考文献
[1] Moore et al., 2020, RAS-targeted therapies: is the undruggable drugged? Nat Rev Drug Discov.
[2] Skoulidis et al.,2015, Co-occurring genomic alterations define major subsets of KRAS-mutant lung adenocarcinoma with distinct biology, immune profiles, and therapeutic vulnerabilities. Cancer Discov.
[3] Zhiwei Liu, et al., 2021, A proteomic and phosphoproteomic landscape of KRAS mutant cancers identifies combination therapies. Molecular Cell.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)