
前列腺是男性生殖器附属腺中最大的实质性器官,由前列腺组织和肌组织构成。正常的前列腺包括腔内上皮细胞、基底上皮细胞和罕见的神经内分泌细胞,以及周围的间质和血管。前列腺癌(Prostate cancer, PCa)是发生在前列腺的上皮恶性肿瘤,是男性泌尿系统最常见的恶性肿瘤之一,近年来我国前列腺癌发病率和死亡率急剧上升。前列腺癌的临床病程具有高度异质性。惰性疾病的患者可以存活数年而无进展,而侵袭性疾病可以迅速转移并变得无法治愈。目前,进展性前列腺癌的治疗仍以雄激素去势治疗(Androgen deprivation therapy, ADT)为主,但雄激素受体(androgen receptor, AR)抑制剂的疗效因人而异,大多数病人最终会发展成去势抵抗性前列腺癌。
目前仍然缺乏有效的生物标记物来指导PCa精准的分子分型及后续治疗。此外,PCa肿瘤微环境中除了前列腺癌细胞,还有免疫细胞、基质细胞等,这些细胞在前列腺癌的发展过程中起到一定作用,但目前对这些类型细胞间的沟通及作用缺少系统全面的研究。单细胞测序可以从更微观层面探索PCa瘤内异质性和复杂的细胞起源,从而帮助研究者在疾病诊断和分层中寻找更好的生物标志物。本文对部分将单细胞测序技术应用于探索早期前列腺癌独特管腔亚群的诊断和分层、鉴定前列腺独特管腔祖细胞类型、探究前列腺管腔细胞的再生潜能、表征前列腺肿瘤微环境异质性等相关文献进行导读,希望为大家的单细胞相关研究带来启发。
案例一
单细胞测序鉴定早期前列腺癌独特管腔亚群的诊断和分层


研究目的:利用基于组织标本的单细胞RNA测序研究前列腺癌的异质性
样本信息:前列腺癌组织
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:7,904个细胞
结论:在前列腺癌组织中发现了15个细胞组,包括3个具有不同表达谱的管腔簇。具有最高拷贝数变异水平和在前列腺癌相关代谢过程中富集的标记基因的管腔簇被认为是恶性簇。该集群包含一个具有前列腺癌生物标记物高表达水平的独特亚群,并且在不同病理分级中对正常前列腺和癌性前列腺具有很强的区分能力。
案例二
前列腺中表达Zeb1基底干细胞亚群的鉴定


研究目的:利用单细胞测序探究前列腺基底细胞内的干细胞亚群
样本信息:小鼠前列腺组织
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:9,000余个细胞
结论:核心上皮-间充质转化(EMT)诱导剂Zeb1在前列腺基底细胞亚群中表达。Zeb1上皮细胞是一种多能干细胞,能够在单细胞水平上自我更新并生成功能性前列腺腺结构,在前列腺基底细胞发育中不可或缺。在小鼠和人类前列腺肿瘤中都可以检测到Zeb1上皮细胞。
案例三
单细胞转录组鉴定前列腺远端内陷尖端中一种独特的管腔祖细胞类型



研究目的:利用单细胞测序技术鉴定前列腺干/祖细胞和前列腺上皮细胞谱系的特征
样本信息:小鼠和人类前列腺组织
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:35,129个小鼠细胞 + 11,374个人类细胞
结论:鉴定了以Tacstd2、Ck4和Psca表达为标志的独特的腔细胞类型(C型腔细胞,Luminal-C)。位于远端前列腺内陷尖端的Luminal-C细胞(Dist-Luminal-C)表现出更大的体外类器官形成能力和体内前列腺上皮导管再生能力。Luminal-C细胞的谱系追踪表明,Dist-Luminal-C细胞通过自我更新和分化重建了远端前列腺内腔谱系。Dist-Luminal-C细胞中Pten的缺失导致前列腺上皮内瘤变。
案例四
单细胞分析显示前列腺管腔细胞的再生潜力


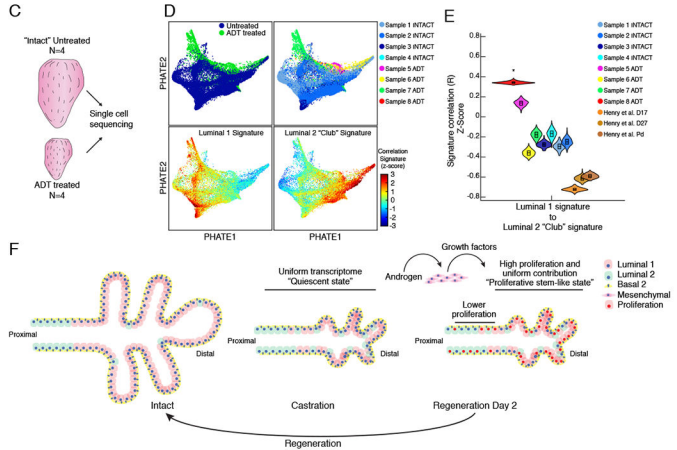
研究目的:利用单细胞测序探索前列腺的可再生干细胞
样本信息:小鼠前列腺
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:13,400个细胞
结论:通过单细胞RNA测序,确定了小鼠前列腺中罕见的表达干细胞样基因的管腔细胞群和大量分化细胞。在类器官和小鼠中,这两个群体对前列腺再生的贡献相同,部分是通过间充质细胞以旁分泌方式作用于管腔细胞,从而通过雄激素驱动生长因子(Nrg2、Rspo3)的表达。对人类前列腺组织的分析显示,在雄激素消融术后,类似分化和干细胞样的腔细胞亚群同样获得了增强的再生潜力。
案例五
ATR抑制诱导CDK1-SPOP信号传导并增强前列腺癌抗PD-L1细胞毒性


研究目的:利用单细胞测序技术探索免疫检查点阻断(ICB)疗法对去势抵抗前列腺癌(CRPC)患者的预后作用
样本信息:小鼠前列腺肿瘤,人类前列腺细胞系
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:NA
结论:ATR抑制剂(ATR;BAY1895433)直接抑制ATR-CHK1信号传导,激活CDK1-SPOP轴,导致PD-L1蛋白失稳。ATRi的这些作用不同于奥拉帕尼,并导致CRPC中cGAS-STING启动、IFN-β介导、自分泌和凋亡反应。在同基因小鼠模型中,ATI与抗PD-L1治疗的结合导致了强大的先天免疫激活和协同的T细胞依赖性治疗反应。
案例六
动态前列腺癌转录组分析揭示疾病进展轨迹



研究目的:利用单细胞测序技术绘制前列腺癌转录组图谱
样本信息:人类和小鼠前列腺肿瘤
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:NA
结论:通过定性和定量的方式描述了肿瘤的进展路线,大多数癌症遵循一条统一的轨迹,其特征是多梳抑制复合物-2、G2-M检查点和M2巨噬细胞极化上调。使用患者来源的异种移植模型,在功能上验证了观察结果,并增加了单细胞分辨率。肿瘤进展是通过转录适应而不是通过选择预先存在的癌细胞簇发生的。
案例七
单细胞分析揭示前列腺癌前病变中对维生素D类似物的细胞类型特异性反应


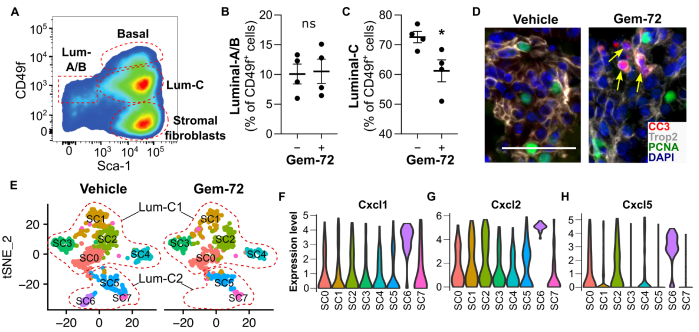
研究目的:利用单细胞测序技术确定维生素D信号通路对前列腺癌前病变的影响
样本信息:小鼠前列腺组织
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:14,515个细胞
结论:Gemini-72(一种具有抗癌活性的维生素D类似物)可诱导衰老PINs凋亡,使基质成纤维细胞的细胞外基质重塑正常化,并减少免疫抑制性髓源性抑制细胞的前列腺浸润。尽管表达Krt8、Krt4和Tacstd2的管腔细胞子集(管腔C细胞)在这种治疗中丢失,但在持续的管腔C细胞中诱导了抗凋亡途径。
案例八
单细胞ATAC和RNA测序揭示与前列腺癌复发相关的预先存在的和持久性细胞



研究目的:采用单细胞染色质可及性(scATAC)和单细胞RNA测序确定在接受治疗时具有再生潜力的预先存在的和治疗持久性的细胞亚群
样本信息:前列腺癌细胞系(LNCaP、VCaP)
测序策略:10×平台,单细胞测序RNA-seq + 单细胞ATAC-seq
捕获细胞数:约30,000个细胞
结论:发现与enzalutamide治疗和耐药性相关的独特染色质景观与其他转录程序有关。持续性细胞的转录谱特征能够对患者的治疗反应进行分层。从临床前模型中定义单细胞群体中染色质和基因表达的变化可以揭示治疗反应的尚未识别的分子预测因子。
案例九
单细胞分析揭示了不同细胞类型中导致人类前列腺癌进展的转录组重构



研究目的:使用单细胞RNA测序探索前列腺肿瘤转录组的异质性
样本信息:人类前列腺癌组织
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:36,424个细胞
结论:肿瘤微环境(TME)显示多个进展相关转录组程序的激活。观察到KLK3的混杂表达,并验证了癌细胞改变t细胞转录组的能力。原发肿瘤和两个匹配的淋巴结图谱提供了证据,KLK3异位表达与微转移相关。细胞与细胞之间存在着紧密的通信。内皮细胞亚群与肿瘤细胞的活跃的通信可促进癌细胞的侵袭。
案例十
单细胞RNA序列揭示了前列腺癌细胞生态系统中亚克隆进化的发育层次叠加


研究目的:利用单细胞测序确定肿瘤的亚克隆演化与肿瘤细胞转录态可塑性之间的关联
样本信息:人类前列腺癌组织
测序策略:10×平台,单细胞测序(scRNA-seq)
捕获细胞数:79,596个细胞
结论:在患者中识别出不同的亚克隆,然后将肿瘤细胞分为四个转录亚型,EMT样(亚型0)、管腔A样(亚型1)、管腔B/C样(亚型2)和基底样(亚型3)。这些亚型在层次上被组织成干细胞样和分化状态。单个原发性肿瘤中的多个亚克隆具有不同的优先亚型组合。此外,亚克隆与肿瘤生态系统中的其他细胞类型表现出不同的通信强度,这可能会调节亚克隆的不同转录亚型。肿瘤细胞转录异质性和细胞生态系统多样性与不良预后特征相关。