2023年2月9日,新华医院蒋更如与林芙君团队在Journal of the American Society of Nephrology杂志(IF:14.978)在线发表题为“ASH2L Controls Ureteric Bud Morphogenesis via Regulation of RET/GFRA1 Signaling Activity in a Mouse Model”的研究论文,该项工作通过构建了一种输尿管芽谱系特异性敲除小鼠模型,综合应用分子生物学、细胞生物学、CUT&Tag、RNA-seq等方法,首次揭示了ASH2L介导的启动子区域H3K4me3修饰调控UB形态发生的全新机制。

发表期刊:Journal of the American Society of Nephrology
影响因子:14.978
涉及的欧易生物服务产品:转录组测序(n=3)、CUT&Tag(n=2,欧易提供了测序及数据分析服务)
上海交通大学医学院附属新华医院蒋更如主任医师、林芙君副主任医师为该文章通讯作者,博士研究生赵梓易为该文章第一作者。
研究背景
先天性肾脏和尿路畸形(CAKUT)是由肾脏和泌尿道胚胎期发育缺陷所导致的以先天性泌尿系统结构异常为临床特征、表型多样的一种疾病,是导致儿童及成人终末期肾病(ESRD)的重要病因。目前,CAKUT的发病机制尚不完全明确,除外科纠正外,针对CAKUT仍无有效治疗手段。
输尿管芽(UB)的形态发生是哺乳动物泌尿系统发生、发育的核心环节。哺乳动物的后肾发育是通过输尿管芽和后肾间充质之间的交互信号诱导完成的。后肾间充质诱导输尿管芽出芽,并支持其发育和分支,最后形成集合管系统;与此同时,输尿管芽不断诱导后肾间充质分化成肾单位。UB的发生、发育及其与临近后肾间充质相互作用的任一环节发生异常都可能造成泌尿系统发育障碍,从而导致CAKUT。详尽阐明UB形态发生的调控机制将有助于人们进一步理解哺乳动物胚胎后肾的发育过程,也将为CAKUT发病机制研究提供新视角。
约有30%的CAKUT病例可归因于GDNF/RET/GFRA1信号通路中的单基因突变,说明了该通路在输尿管芽发育的重要性。此外,最近的表观基因组研究证据表明,CAKUT也可能由组蛋白修饰缺陷或异常引起。例如,敲除影响组蛋白甲基化或乙酰化的相关基因,也可在小鼠中导致CAKUT样表型。KMT2D基因(编码产物介导H3K4甲基化)的杂合突变也与歌舞伎综合征(一种综合征型CAKUT)相关。但是,H3K4甲基化异常是如何导致CAKUT的,目前尚不清楚。
研究内容
基因Ash2l编码COMPASS甲基转移酶的一个亚基,对于H3K4甲基化修饰的建立是必不可少的。为了阐明H3K4甲基化在后肾发育中的作用,研究者首先构建了一种输尿芽谱系中特异性失活Ash2l的小鼠,发现ASH2L缺陷可导致新生小鼠出现多种CAKUT表型,而这些表型主要源于胚胎发育期UB生长延迟和分支形态发生受损。为进一步阐明ASH2L缺失导致CAKUT表型的分子机制,研究者通过RNA-seq和CUT&Tag数据的联合分析发现,UB特异性ASH2L敲除小鼠UB细胞中RET/GFRA1信号通路核心组分如Ret、Gfra1和Wnt11基因的表达显著减少,并且与ASH2L缺陷所导致的启动子区域H3K4me3修饰减少有关。
研究结果
Result1 在UB谱系中特异性失活Ash2l会导致小鼠CAKUT样表型
研究团队首先基于Cre/loxP系统构建了一种在UB谱系中特异性失活Ash2l的小鼠(以下简称“Ash2l突变小鼠”),并且证明了Ash2l在突变小鼠的UB谱系中低表达,但在周围帽状间充质细胞中正常表达,且H3K4me3以及H3K4me1/2水平也存在类似的结果。Ash2l突变小鼠未能存活至断乳,新生小鼠出现双侧肾发育不良、输尿管梗阻等多种CAKUT表型(图1)。

图1 在UB谱系中特异性失活Ash2l会导致出生时的CAKUT样表型
Result2 Ash2l突变表现为UB生长延迟和分枝形态发生受损
接下来,为了阐明该基因失活如何导致出生时的CAKUT表型,研究团队分析了胚胎发育过程中不同时间点的Ash2l突变小鼠(图2A),并通过后肾原基体外培养进行了验证(图2B-D),结果显示Ash2l在UB谱系中的失活延迟了UB的出芽并损害了分支形态发生。
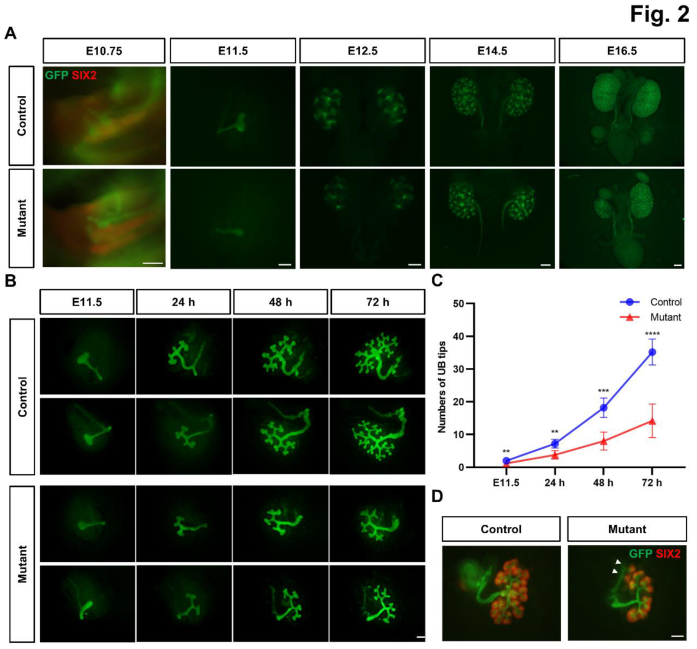
图2 UB谱系中的Ashl2特异性失活延迟了UB的诱导并损害了分支形态发生
Result3 UB谱系Ash2l失活减缓细胞增殖
为了说明在Ash2l突变小鼠中观察到的分支缺陷是否与细胞增殖减少和/或凋亡增加有关,研究团队对E16.5时期的后肾进行了免疫荧光染色实验。结果显示Ki67和EdU阳性的UB细胞在突变小鼠中显著减少,说明其细胞增殖能力下降(图3A-D)。相反,TUNEL染色显示对照组和Ash2l突变体肾脏的凋亡水平相似(图3E-F)。这些结果表明,UB谱系中的Ashl2失活是通过降低细胞增殖而不是通过促进细胞凋亡来阻碍UB分支。
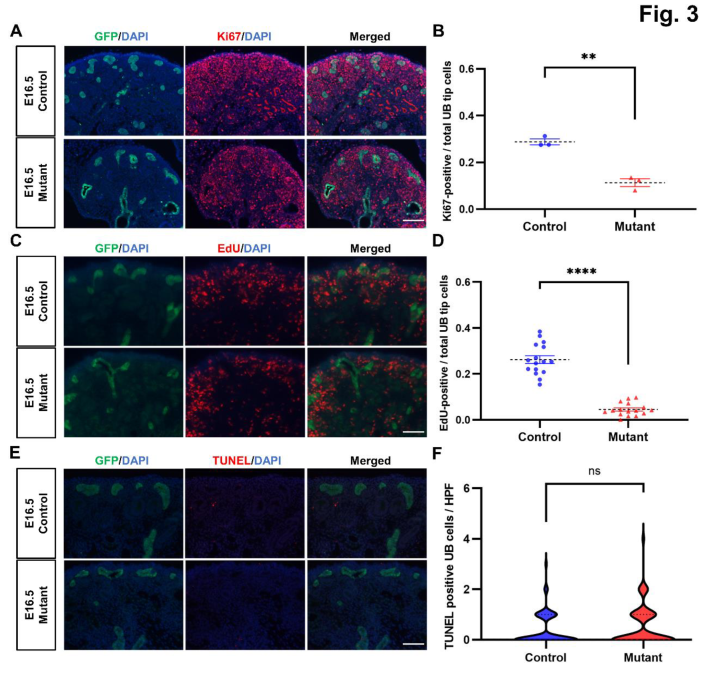
图3 UB谱系中的Ashl2失活通过降低细胞增殖而不是促进细胞凋亡来阻碍分支
Result4 Ash2l失活下调RET/GFRA1信号通路
为了确定H3K4甲基化缺陷是否以及如何影响UB谱系中的基因表达,首先研究团队通过转录组测序技术,在E16.5 UB细胞中比较了Ash2l突变组和对照组之间的基因表达情况。从中鉴定出1764个差异表达基因(935个基因上调,829个基因下调)(图4A-B)。下调基因在细胞周期、细胞分裂、多细胞生物发育、信号转导等GO生物过程中显著富集(图4C),其中部分差异表达基因参与了输尿管芽诱导和分支的调节(图4D),相关基因表达水平改变也通过qRT-PCR实验进行了验证(图4E)。
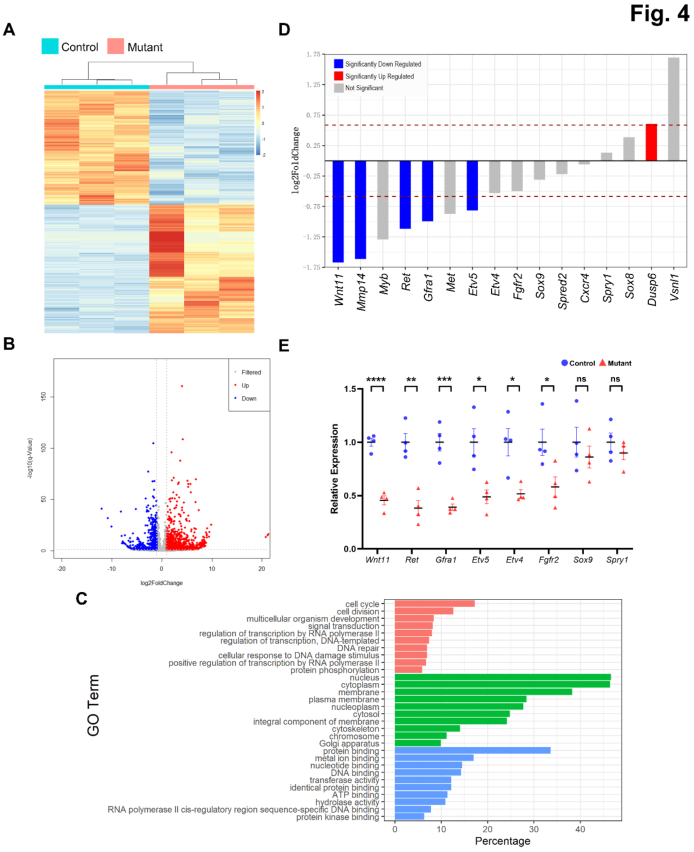
图4 UB谱系Ashl2失活改变了基因表达

图5 基于RNAscope和免疫组化,验证UB谱系Ash2l失活后差异表达的基因
Ret、Gfra1和Wnt11通过激活RET/ GFRA1信号通路调控UB形态发生。这些基因在Ash2l突变体的UB细胞中被下调了2- 3倍,RNAscope和免疫组化实验分别在mRNA和蛋白水平上都证实了这种下调(图5)。此外,通过RNAscope分析观察到这些基因在E12.5早期分支事件中就发生了表达改变(图5),且这种改变与突变后肾中UB顶端细胞数量相对减少无关,因为其他UB顶端细胞的marker基因在突变体中没有出现显著下调。
因此,研究者进一步探索了Ret、Gfra1和Wnt11下调与H3K4甲基化缺失有关的证据。首先研究者从对照组和突变体E16.5胚胎肾中分离出了GFP阳性的UB细胞,并进行了CUT&Tag测序,从而描绘了UB谱系的H3K4me3图谱。数据分析显示,大多数H3K4me3修饰发生在基因启动子上,在突变体中,转录起始位点附近的reads显著减少(图6A),且H3K4me3 peaks主要富集在启动子区和远端基因间区(图6B),这与之前的报道一致。为了确定H3K4me3是否正向调控基因表达,研究者将CUT&Tag数据与RNA-seq数据进行了整合分析,结果显示H3K4me3与转录激活密切相关。将突变体转录下调的基因(DRGs)与H3K4me3 peaks相关基因进行韦恩分析,发现829个DRGs中大多数基因被H3K4me3修饰(图6C),对重叠的667个基因进行KEGG富集分析,发现细胞周期通路被显著富集(图6D),在这些基因中,Ret、Gfra1和Wnt11的启动子区均显示出高水平的H3K4me3修饰富集(图6F)。这些结果表明,UB谱系中的Ash2l的失活导致H3K4me3缺陷,从而下调了RET/GFRA1信号。

图6 E16.5阶段UB谱系肾脏的H3K4me3全基因组景观
研究结论
本研究证明了Ash2l介导的H3K4甲基化修饰通过激活RET/GFRA1信号通路而作为后肾发育的关键调节因子,这些过程的缺失或调节异常可能导致CAKUT,为治疗这种先天性疾病提供了新的方向。此外,研究者还首次详细分析了H3K4me3在UB谱系中的全基因组分布,扩展了之前对肾单位祖细胞(NPCs)组蛋白修饰的研究。

【参考文献】
Zhao Z, Dai X, Jiang G, Lin F. ASH2L Controls Ureteric Bud Morphogenesis via Regulation of RET/GFRA1 Signaling Activity in a Mouse Model [published online ahead of print, 2023 Feb 9]. J Am Soc Nephrol. 2023;10.1681/ASN.0000000000000099.
doi:10.1681/ASN.0000000000000099.
猜你想看
1、Cell | 肿瘤蛋白基因组学探究胰腺导管腺癌的治疗与特征
2、项目文章 | 转录组测序探究基于骨靶向外泌体治疗炎症性肠病骨丢失
3、项目文章 | 单细胞测序揭示人胎盘内皮细胞及滋养细胞的异质性和分化
4、项目文章 | 单细胞表达图谱揭示了克罗恩病爬行脂肪的细胞异质性