不少小伙伴们已经想到,倘若肿瘤细胞发生铜死亡,一定大大有利!那么肿瘤细胞是否存在铜稳态?如何调节肿瘤细胞的铜稳态?又有哪些检测 “秘籍” 呢?今天就随小 M 一起来看下铜死亡 “爆红” 的背后故事吧~
随着铜死亡机制的确立[1][2],相关研究也愈发受到各大期刊的 “宠爱”,往期小 M 为大家介绍过其详细机制及与其他已知细胞程序性死亡的区别 (详见往期推文:空降"热搜" 铜死亡丨解锁细胞死亡新方式; 热度 “蹭蹭蹭”的铜死亡,你了解多少?)。
然而最吸引人的便是借助铜死亡这把利剑,刺向肿瘤细胞!那么今天这期铜死亡 “爆红” 的背后故事就从肿瘤细胞的铜稳态开始吧~
▐ 肿瘤细胞的铜稳态
铜是人体所需必需酶的辅助因子,可通过跨浓度梯度作用维持其稳态。通常情况下,细胞内铜浓度保持在极低水平,在癌细胞中也是如此,铜离子的正常功能依赖于集中不同类型蛋白质的相互作用:铜经由血液系统运输,被转送到细胞表面。Cu2+ 会被膜表面 STEAP 蛋白催化还原为 Cu+,而具备更强的细胞毒性。进入细胞的铜离子,依次通过 COX17 和 SLC25A3 穿过线粒体外膜和线粒体内膜,进入线粒体基质。当然,还在细胞质的铜离子也会与铜离子螯合剂 GSH 和 MT 结合,中和铜的细胞毒性,或被铜离子伴侣 CCS 携带至 SOD1,调节细胞内活性氧平衡,多种环节共同参与细胞铜稳态的调节[2]。
图 1. 肿瘤细胞中铜离子的稳态调节[2]。
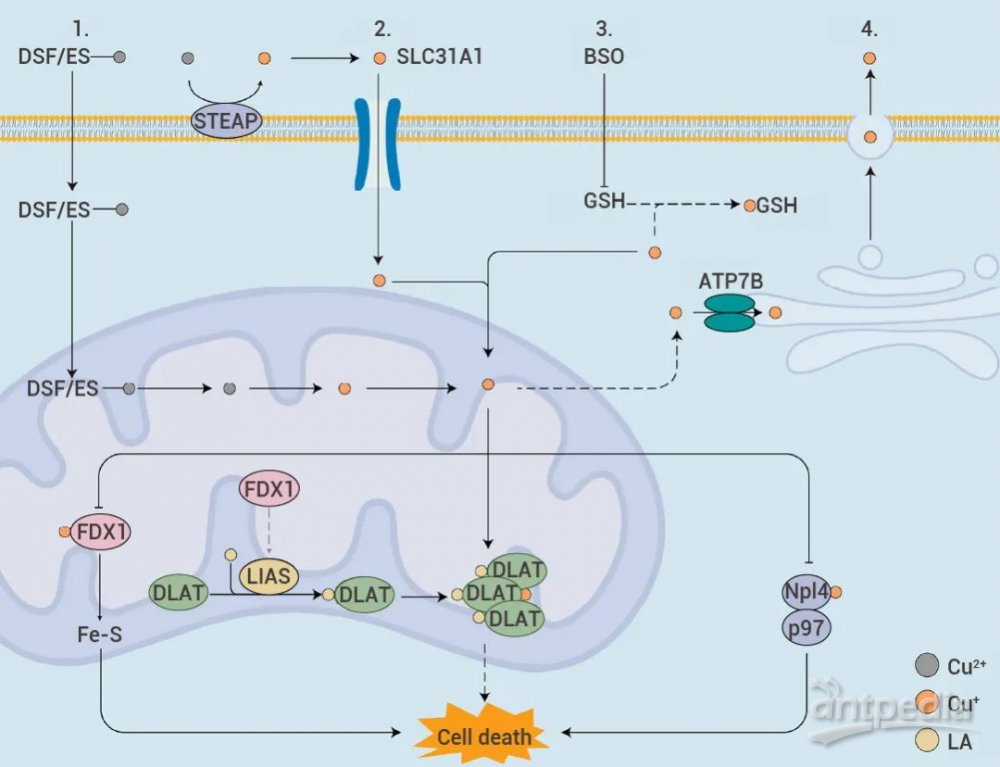
铜稳态的失调会导致细胞代谢紊乱。当铜离子因离子载体或转运蛋白过度积累后,一方面,FDX1 将 Cu2+ 还原成更具毒性的 Cu+,抑制线粒体呼吸相关的铁硫簇蛋白 (Fe-S Cluster) 的合成,引起蛋白质毒性应激反应,最终导致细胞死亡[1]。另一方面,FDX1 作为蛋白质硫辛酰化修饰的上游调节因子,参与调节 DLAT 的硫辛酰化[1][3]。Cu2+ 可以直接结合并诱导 DLAT 的异聚化,这种不溶性 DLAT 的增加导致细胞蛋白毒性应激,诱导细胞死亡。
图 2. 铜诱导的细胞死亡的示意图[3]。

肿瘤治疗的战斗向来困难重重,铜死亡的研究为其提供了一种新的杀死肿瘤的方式。那么如何触发铜死亡这一利器为我们所用呢?总的来说,可以通过提高细胞内游离铜离子浓度,从铜的吸收、输出和储存等方面来触发铜死亡。铜离子进出细胞由铜离子转运蛋白 SLC31A1 和 ATP7B 控制。可通过:(2) 敲低 ATP7B,减少铜外流,调节细胞内铜离子浓度;(4) 通过使用丁硫氨酸亚磺酰亚胺(BSO) 消耗内源性细胞内铜螯合剂谷胱甘肽 (GSH),避免 GSH 螯合游离铜离子。图 3. 提高细胞内游离铜离子浓度的 4 种方式[2]。
由此,过量的 Cu2+ 或其更具毒性的还原态 Cu2+ 输入细胞,通过与硫辛酰化的 DLAT 结合,进一步导致 DLAT 寡聚化。同时,Cu 还诱导 Fe-S 稳定性降低或 Npl4-p97 失活,产生专属铜诱导机制的细胞死亡[4]。当然,铜死亡的研究必不可少的便是相关指标检测!其主要包括:(2) 相关标志物检测,如 Fe-S 簇蛋白 FDX1 和 LIAS 是铜死亡的标志,DLAT 和 DLST 的脂酰化的减少和 HSP70 水平增加,产生蛋白毒性应激并最终导致细胞死亡;(3) 代谢指标检测,如铜离子积累,α-酮戊二酸的积累,以及琥珀酸减少。NP@ESCu: 一种纳米颗粒,包含 Elesclomol, Cu 等。
左右滑动查看更多
铜死亡的主要形态学表现是线粒体皱缩、细胞膜破裂、内质网损伤和染色质破裂等[3]。Guang Zhao 等人在研究铜积累与视网膜发育畸形和疾病之间关系时,测量了铜过量时胚胎的形态学特征 (图 4 E)。TEM 分析显示,铜处理的胚胎视网膜细胞的内质网和线粒体结构被破坏。与对照组相比,在铜处理视网膜细胞中,线粒体内膜减少并产生大液泡 (E1-E3, 红色),内质网形成松散结构 (E4-E6, 绿色)[12]。
图 4. 铜处理后对视网膜细胞的 TEM 分析[12]。
研究发现,铜离子载体 Elesclomol 在心肌细胞中诱导铜死亡,其特征是 Fe-S 簇蛋白的减少和线粒体酶脂酰化的减少。Int J Mol Sci 发表的 “探究铜死亡对糖尿病心肌病中 AGEs 诱导的心肌细胞功能障碍的潜在影响” 中,作者通过 Western Blot 检测了 ES-Cu 诱导肌细胞发生铜凋亡后的标志性变化。结果表明,多种线粒体 Fe-S 簇蛋白如 FDX1、LIAS、ACO2、ETFDH 和 NDUFV1 等,均下调表达 (图 5A);DLAT 和 DLST 蛋白质脂酰化减少 (图 5B)。此外,作者对糖尿病 (db/db) 小鼠心肌组织中 Fe-S 簇蛋白进行蛋白质印迹分析(图 5C-D),发现 db/db 小鼠的心脏中 Fe-S 簇蛋白 FDX1、LIAS、NDUFS8 和 ACO2 丢失,且 HSP70 丰度增加[8]。

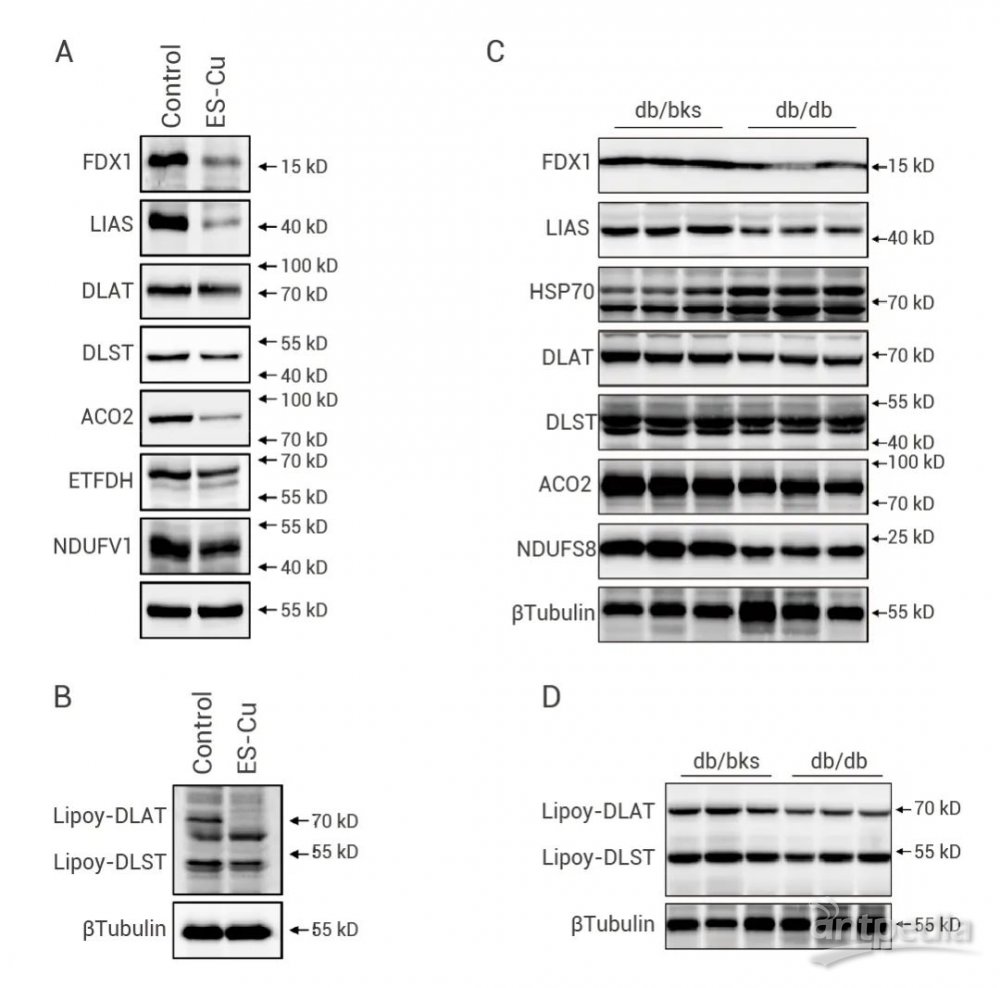
图 5. Fe-S 簇蛋白及蛋白质脂酰化的 Western Blot 分析[8]。▐ (三) 代谢指标检测
FDX1 的功能取决于丙酮酸和 α-酮戊二酸积累、避免琥珀酸的消耗,从而保证 PDH 和 α-酮戊二酸脱氢酶的 TCA 循环,导致蛋白质脂肪酰化[1]。Tian 等人利用设计了一种纳米佐剂 CS/MTO-Cu@AMI,其中包含 MTO 、Cu2+ 和外泌体分泌抑制剂 AMI 等 (图 6A)。为了验证铜死亡,作者分析了 HSP 70 和 LIAS 的表达,并检测了三羧酸循环中关键代谢物的变化。结果表明,CS/MTO-Cu@AMI 处理显著促进 HSP 70 的表达,同时下调 LIAS 的表达 (图中未显示)。此外,与对照组相比,CS/MTO-Cu@AMI 组三羧酸循环中的丙酮酸和 α-酮戊二酸含量均增加了 40%,而琥珀酸含量下降了 45% (图 6B-D),有力地支持 CS/MTO-Cu@AMI 可以有效诱导铜死亡[10]。

图 6. 不同处理后细胞的琥珀酸, α-酮戊二酸, 丙酮酸的相对水平[10]。
 Tips:
Tips:
纳米佐剂 CS/MTO-Cu@AMI:Cu2+ 有效地触发铜死亡诱导的线粒体功能障碍,激活 AMPK 途径介导的 PD-L1 蛋白降解,剥夺巨噬细胞和外泌体释放的能量供应,放大细胞内细菌灭活的氧化应激,从而在体外和体内有效地增敏化疗并激活全身抗肿瘤免疫。
本期小 M 为大家介绍了肿瘤细胞中铜的稳态调节,可从铜的吸收、输出和储存等方面采取多种措施提高细胞内游离铜离子浓度,进而触发铜死亡,与肿瘤发展做斗争!此外,小 M 还为大家整理了铜死亡的相关检测指标和方法,方便大家的实验研究~

Elesclomol (STA-4783)
是一种铜离子载体,能够特异性结合铁氧还蛋白 1 (FDX1) α2/α3 螺旋和 β5 链,抑制 FDX1 介导的 Fe-S 簇生物合成,促进铜死亡。
|
Disulfiram
是一种铜离子载体和 ALDH1 抑制剂,对酒精具有急性敏感性。它可增加细胞内 ROS 水平,诱导铜死亡。
|
Cu(II)GTSM 是一种铜复合物,具有细胞通透性。它可显著抑制 GSK3β、Amyloid-β 寡聚体 (AβOs),降低 tau 磷酸化。
|
Penicillamine 是一种重金属螯合剂,是 Penicillin 的代谢降解产物。它可增加游离铜,增强氧化应激。
|
铜死亡化合物库 MCE 可以提供 164 种靶向铜死亡相关靶点及通路的化合物,我们将在明确您的产品用途后,向符合资质的客户通过定制合成服务的方式提供 MCE 铜死亡化合物库。MCE 铜死亡化合物库库是癌症、风湿类风湿性关节炎等相关疾病药物研究的有用工具。 |
|

[1] Tsvetkov P, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 2022 Mar 18;375(6586):1254-1261. [2] Xie J, et al. Cuproptosis: mechanisms and links with cancers. Mol Cancer. 2023 Mar 7;22(1):46. [3] Wang Y, et al. Cuproptosis: a new form of programmed cell death. Cell Mol Immunol. 2022 Aug;19(8):867-868. [4] Skrott Z, et al. Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4. Nature. 2017 Dec 14;552(7684):194-199. [5] Guo B, et al. Cuproptosis Induced by ROS Responsive Nanoparticles with Elesclomol and Copper Combined with αPD-L1 for Enhanced Cancer Immunotherapy. Adv Mater. 2023 Jun;35(22):e2212267. [6] Wu H, et al. Copper sulfate-induced endoplasmic reticulum stress promotes hepatic apoptosis by activating CHOP, JNK and caspase-12 signaling pathways. Ecotoxicol Environ Saf. 2020 Mar 15;191:110236. [7] Yang W, et al. 4-Octyl itaconate inhibits aerobic glycolysis by targeting GAPDH to promote cuproptosis in colorectal cancer. Biomed Pharmacother. 2023 Mar;159:114301. [8] Huo S, et al. ATF3/SPI1/SLC31A1 Signaling Promotes Cuproptosis Induced by Advanced Glycosylation End Products in Diabetic Myocardial Injury. Int J Mol Sci. 2023 Jan 14;24(2):1667. [9] Xu Y, et al. An Enzyme-Engineered Nonporous Copper(I) Coordination Polymer Nanoplatform for Cuproptosis-Based Synergistic Cancer Therapy. Adv Mater. 2022 Oct;34(43):e2204733.[10] Tao X, et al. A tandem activation of NLRP3 inflammasome induced by copper oxide nanoparticles and dissolved copper ion in J774A.1 macrophage. J Hazard Mater. 2021 Jun 5;411:125134. [11] Tian H, et al. Clinical Chemotherapeutic Agent Coordinated Copper‐Based Nanoadjuvants for Efficiently Sensitizing Cancer Chemo‐Immunotherapy by Cuproptosis‐Mediated Mitochondrial Metabolic Reprogramming[J]. Advanced Functional Materials, 2023: 2306584. [12] Zhao G, et al. Copper induce zebrafish retinal developmental defects via triggering stresses and apoptosis. Cell Commun Signal. 2020 Mar 14;18(1):45.


















 Tips:
Tips:







