近几年,随着研究的深入,I型糖尿病与自身免疫之间的关系逐渐被揭露出来,众所周知,T细胞在胰腺β细胞的破坏中起主要作用,但促进异常T细胞活化的分子机制却仍然知之甚少。
近日,来自慕尼黑大学实验室的研究人员发现了一种破坏调节性T细胞(Tregs)分化和稳定性的机制,抑制触发该机制的分子,可促进功能性Tregs再次形成,从而导致自身免疫激活的减少,这意味着一个新的分子靶点的“诞生”,有望延缓甚至预防1型糖尿病的发生!相关结果以“miRNA142-3p targets Tet2 and impairs Treg differentiation and stability in models of type 1 diabetes”为题在线发表在《nature communications》杂志上。

在1型糖尿病患者和健康者体内均能发现胰岛β细胞特异性自身反应性T淋巴细胞,通常被包括调节性T淋巴细胞在内的免疫调节系统所控制,一旦针对胰岛抗原的自身免疫耐受平衡被打破,这些自身反应性T淋巴细胞就会特异性地破坏胰岛β细胞。
据推测,在“前驱症状”期间或确诊之前,调节性T细胞无法控制细胞毒性T细胞针对自身蛋白的攻击,CD4和CD8T细胞可协调攻击并破坏β细胞,而且B细胞还会产生自身抗体来对抗β细胞蛋白,有些β细胞重新形成(通过细胞分裂或新细胞形成)来取代被破坏的细胞。但随时间推移,被破坏的细胞量远远多于被替代的细胞。当β细胞数量减少约80%时,机体无法分泌足够的胰岛素,导致血糖升高以及临床诊断为糖尿病。
来自美国的研究人员发现,T淋巴细胞能够通过释放含有miR-142-3p、miR-142-5p和miR-155的外泌体作用于胰岛β细胞,促进β细胞凋亡。这已被证实是Ⅰ型糖尿病产生发展机制的一部分。
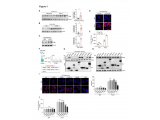
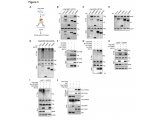
在体外,β细胞内这些miRNA的失活保护它们免受T淋巴细胞外泌体诱导的细胞凋亡,并在体内阻止NOD小鼠(一种众所周知的T1D模型)中的T1D发展。而在本次研究中,研究人员观察到,miR142-3p在这一过程中发挥了决定性的作用。在NOD小鼠发病过程中,他们检测到miR142-3p的丰度明显增加,进而导致辅助性T细胞中Tet2蛋白的表达减少。最终,调节性T细胞的Foxp3基因(转录因子Foxp3被认为是调节性T细胞最重要的调控因子)发生了错误的表观遗传改变。这些重要免疫细胞的数量减少了,Tregs失去稳定性,这一系列的级联反应最终导致了自身免疫病,如I型糖尿病的发生。

miR-142-3p在CD4 + T细胞中表达丰富,并在胰岛自身免疫中上调
如此看来,miR142-3p与调节性T细胞功能受损有直接联系,真凶找到了,那揪出背后真凶又能否逆转这一过程呢?接下来,研究人员在体外阻断了miR142-3p分子的产生,结果发现,Tregs的稳定性得到了极大程度上地改善,不仅如此,功能性Tregs的数量也较前增多。相应地,在动物模型中,胰岛素生成β细胞的自身免疫反应也有所降低。
本次研究表明,miR142-3p的靶向抑制可以开辟新的途径来降低免疫系统对自身产生胰岛素细胞的活性。为了进一步研究特定miRNAs的靶向抑制潜力,提高miR142-3p抑制剂在相关靶细胞中的选择性和靶向积累是当务之急。另外,丹尼尔的研究小组还希望进一步确定受miR142-3p调控的基因,以便更确切地找到应对 I型糖尿病的治疗对策。