“师兄,我最近的课题需要构建一种1型糖尿病小鼠,看了很多文献,现在仍然很苦恼,不知道该选哪一种?文献看得我晕头转向,你能帮帮我吗?”
在座的各位同学,你们还在为频繁的请教师兄师姐问题而感到麻烦和烦恼吗?小编面皮薄且内向的人,每次请教师兄都感觉特别不好意思,生怕打搅到师兄,次数多了就会特别纠结到底要不要去请教呢?(小编就是这样弱)
那么,面对文献里的各类动物模型,哪一种才是适合我们的实验研究呢?这还真是个难题!不要急,和小编往下看。
上一期我们从整体上了解糖尿病的基本概况及其动物模型的基本分类,主要包括1型糖尿病和2型糖尿病,这次我们就从1型糖尿病动物开始,为大家详细介绍常见的模型种类、构建方法及其应用范围等,为你的实验之路省时省力。
什么是1型糖尿病
1型糖尿病(Type1 diabetes),是一种由于自身免疫反应而导致能够分泌胰岛素的胰腺β细胞被破坏,使β细胞不能产生足够的胰岛素(或者不产生胰岛素)来降低血糖,以至于机体处于长期高血糖(Hyperglycemia)状态。其病因目前未知,可能是遗传和环境因素共同导致。
典型的症状是频繁排尿,口渴,饥饿增加和体重减轻,俗称“三多一少”。一般通过测试血中血糖水平或糖化血红蛋白(HbA1c)的水平来诊断是否患糖尿病。
常用的1型糖尿病动物模型
1型糖尿病小鼠种类比较多,首先你需要明确你的实验目的,进而选择正确的动物模型,比如相对简单和便宜的模型就是:STZ药物诱导,用于药物评价;如果你想研究发病中的信号通路,可能最好选择NOD小鼠了。下面就来具体看看。
如表1简单概括了常见的1型糖尿病的动物模型,主要有化学药物诱导的,如链脲佐菌素(STZ)模型,自发性自身免疫模型,如NOD小鼠模型,BB大鼠模型,也有遗传诱导、病毒诱导等大鼠小鼠模型,这些模型并没有严格的区别,主要看研究者的目的和研究侧重点。
 表1. 1型糖尿病啮齿动物模型的特点和应用
表1. 1型糖尿病啮齿动物模型的特点和应用
一
化学诱导的1型糖尿病
1. 链脲佐菌素(STZ)诱导模型
造模机理:利用STZ的毒性破坏胰岛,造成胰岛素分泌丧失。
如图1,STZ是一种葡糖胺-亚硝基脲化合物,通过腹腔注射(ip)或静脉注射(iv)给药后,通过Glut-2转运体(Glut-2transporter)进入胰腺β细胞,导致DNA的烷基化。随后激活PARP导致NAD+消耗增加,细胞ATP减少,最终使胰岛素产生受到抑制,此外,STZ是自由基的一个来源,自由基的增多也有助于DNA损伤和加速β细胞死亡。
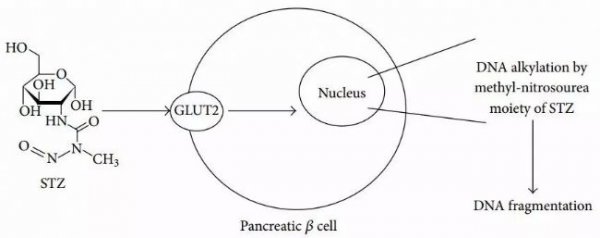 图1.STZ诱导1型糖尿病的作用机理图
图1.STZ诱导1型糖尿病的作用机理图
链脲佐菌素(STZ)诱导模型包括高剂量和多次低剂量STZ法
①高剂量STZ 法
小鼠品系:几乎所有小鼠品系都可以,但存在品系和个体差异
小鼠周龄: 8W~12W
STZ溶液的配置:柠檬酸缓冲液溶解STZ,调PH=4.2~4.5,冰浴避光保存,30min内用完
给药周期和方式:只注射一次,小鼠中单次高剂量的剂量范围为100~200mg·kg-1,大鼠35~65mg·kg -1,促进β细胞的快速消融和高血糖,一般腹腔注射(操作相对方便)或者尾静脉注射(省药量,但难度大)
模型成功的判断标准:一般第二天就能检测血糖,空腹血糖>16.7mmol/L
特点:对胰岛β细胞的破坏力大于多次低剂量STZ,死亡率高
②多次低剂量STZ
构建方式与高剂量相比,主要是给药周期不同:大部分以24h为周期(药力发挥主要集中在24h内),给药次数每个实验方法都有不同,2-7次,以给药3次居多。
每天剂量范围20~40mg·kg-1,胰岛数量和体积会明显减少,同时胰岛素分泌能力也逐渐降低。
特点: 死亡率低,但成模率也相对较低,稳定性差
目前邦耀实验室已经成功掌握STZ诱导的构建方法,并且利用该模型已经发表文章(参考文献3)此方法简单便宜快捷,重复性高,是研究1型糖尿病的经典动物模型。
2. 四氧嘧啶(Alloxan)诱导模型
造模机理:主要是胰岛β细胞的快速摄取四氧嘧啶抑制葡糖激酶(glucokinase)和过多自由基的形成。
小鼠品系、小鼠周龄、造模方法、给药方式,基本同上;
给药浓度:注射前用生理盐水配置成1%的溶液,剂量范围为50至200mg·kg-1,大鼠的剂量为40至200mg·kg-1,小鼠的这取决于动物品系和给药途径,如:腹腔注射(ip)和皮下注射(sc)需要静脉注射(iv)三倍的剂量;
给药周期:禁食12h,一次给药;
模型成功的判断标准:一般在给药后每2-3天检测血糖,血糖值≥14.5mmol/L。
主要应用和优点:
①测试药物治疗效果,如测试胰岛素的新制剂,测试移植治疗;
②提供了简单和相对便宜的糖尿病模型,而且还可以用于高等动物。
缺点:
①可引起肝、肾、肺、肠、睾丸和脑毒性,尤其四氧嘧啶具有狭窄的糖尿病剂量,甚至较少的剂量给药就可引起很大的毒性,特别是肾脏毒性;
②STZ和四氧嘧啶相对不稳定,所以溶液应当现配现用。
二
自发性自身免疫模型的 1型糖尿病
1. NOD小鼠
NOD(Non-Obese Diabetic mice)小鼠是由日本大阪的Shionogi实验室在1974年开发,约在3-4周龄时出现胰岛炎,胰岛白细胞浸润,10~14周开始自发性发生糖尿病。24~30周龄变成明显糖尿病,此时体重会迅速减轻,发病率存在性别差异(雌性90%,雄性50-60%)。
主要应用和优点:
①帮助识别可以导致1型糖尿病的许多遗传和信号通路的模型;
②MHC2类分子(TheMHC class 2)与人的结构相似,与人类有相似的该疾病的抗性或易感性;
③测试其中靶向自身免疫应答的调节治疗,用于自身免疫模型的复发模型。
缺点:
①需要在无特定的无病原体(SPF)条件下维持糖尿病发病率(与微生物暴露负相关);
②存在性别差异;
③疾病发作不可预测;
④价格相对昂贵,对药物干预治疗的时间点要求苛刻(早期给药)。
2. BB大鼠
BB(Biobreeding)大鼠来自远交系Wistar大鼠,1974年首次在加拿大殖民地培育,来源于俩个亚系,一个近交(BBDP/ Wor)和一个远交(BBdp)。青春期后发生糖尿病,80%大鼠8~16周发展成为糖尿病,胰岛炎(insulitis)发生先于周围胰岛炎(peri-insulitis),发病无性别差异,糖尿病表型明显。
主要应用和优点:
①阐明关于1型糖尿病的遗传学更具价值;
②胰岛移植耐受的首选小动物模型;
③干预研究和糖尿病性神经病变的研究。
缺点:
①淋巴细胞减少症(CD4 + T细胞严重减少和几乎没有CD8 + T细胞);
②需要胰岛素治疗才能存活。
三
遗传诱导的胰岛素依赖性糖尿病
AKITA小鼠
AKITA小鼠来源于日本Akita,C57BL/ 6NS1c小鼠,由于胰岛素基因2(Insulin-2)的自发突变,导致胰岛素蛋白错误折叠,内质网功能紊乱,从3至4周龄开始出现严重的胰岛素依赖性糖尿病,即表现为高血糖,低胰岛素血症,多尿和多饮。
主要应用和优点:.
①作为移植研究中链脲霉素处理的小鼠的替代物;
②用作1型糖尿病大血管病和神经病变的模型;
③用于胰岛中ER应激的缓解研究,这方面具有2型糖尿病的一些病理学特点。
缺点:未用胰岛素治疗的纯合子小鼠很少存活超过12周。
四
其他1型糖尿病的大动物模型
除了广泛研究的1型糖尿病啮齿动物模型,目前,已经开发了几种大动物模型。在大型动物模型中,自发性糖尿病相对罕见且不可预测,因此才需要人工诱导1型糖尿病的模型
在大模型中诱导胰岛素依赖的最常见的方法是通过胰腺切除术(Pancreatectomy)或STZ胰腺切除术,顾名思义,就是切除动物的胰腺,一般由熟练的外科医生完成。大动物建立STZ诱导的糖尿病模型,困难更大,不仅需要使用更大的剂量,模型的可重复性和稳定性差,而且价格昂贵,一般实验室难以承受。
五
病毒诱导型
病毒诱导的糖尿病模型,用于诱导糖尿病动物模型包括coxsackieB 病毒、encephalomyocarditis病毒和Kilham大鼠病毒,诱导机理复杂,病毒的复制水平以及感染的时间很难把握,实验防护级别要求高,造模需要条件苛刻,性价比相对较低,一般实验室也不采用此法。
综上所述,我们为大家详细介绍了几类1型糖尿病模型,主要包括化学诱导(STZ)自发性自身免疫模型及遗传诱导的胰岛素依赖性糖尿病的1型糖尿病模型等,我们在实验中可以根据自己的实验目的并结合实验室的条件选择对应的动物模型。
参考文献
[1] Dhuria RS, Singh G, Kaur A, Kaur R, Kaur T. Current status and patent prospective of animal models in diabetic research. Advanced Biomedical Research. 2015;4:117. doi:10.4103/2277-9175.157847.
[2] Al-awar Amin, Kupai K, Veszelka M, et al. Experimental Diabetes Mellitus in Different Animal Models. Journal of Diabetes Research. 2016;2016:9051426. doi:10.1155/2016/9051426.
[3] Zheng C, Zhou W, Wang T, et al. A Novel TGR5 Activator WB403 Promotes GLP-1 Secretion and Preserves Pancreatic β-Cells in Type 2 Diabetic Mice.[J]. PLOS ONE, 2015, 10(7).
[4] Hansen K, Khanna C. Spontaneous and genetically engineered animal models; use in preclinical cancer drug development. Eur J Cancer. 2004;40:858–80.
[5] Bansal R, Ahmad N, Kidwai JR. Alloxan-glucose interaction: effect on incorporation of 14C-leucine into pancreatic islets of rat. Acta Diabetol Lat. 1980;17:135–143.
[6] Sheshala R, Peh KK, Darwis Y. Preparation, characterization, and in vivo evaluation of insulin-loaded PLA-PEG microspheres for controlled parenteral drug delivery. Drug Dev Ind Pharm. 2009;35:1364–1374.
[7] Chatzigeorgiou A, Halapas A, Kalafatakis K, Kamper E. The use of animal models in the study of diabetes mellitus. In Vivo. 2009;23:245–58.
[8] Polychronakos C. Animal models of spontaneous autoimmune diabetes: notes on their relevance to the human disease. Curr Diab Rep. 2004;4:151–4.