Vala KIC高内涵细胞分析仪助力心衰竭靶向miRNA筛选及机制研究
心力衰竭是各种心血管疾病的顶峰,包括高血压、缺血性疾病和动脉粥样硬化,瓣膜病功能不全、心肌炎和收缩性蛋白突变及收缩功能逐渐丧失为特征的。普遍的治疗策略是阻断肾素-血管紧张素和交感神经系统的有害作用
,但目前的药物很少是靶向衰竭心肌细胞机制的, 因此迫切需要开发新的药物,特别是用于治疗患者晚期心力衰竭的药物
。复杂的细胞内网络可以平衡与工作复核相关的收缩力和细胞内Ca2+处理能力;然而,miRNAs在心脏收缩性中的作用仍然很大未开发,miRNA几乎对所有正常和病理过程都可微调,并通过下调占据关键节点的蛋白质生物控制网。因此我们推测心衰竭时,miRNA的抑制收缩能力会上调,可能用作治疗干预的新靶点。
钙转运的ATP酶SERCA2a是钙摄取的主要机制。心肌细胞兴奋-收缩偶联过程中,SERCA2a的表达降低及活性减少导致钙摄取损伤是心衰竭的重要标志,通过基因转染恢复相应的SERCA2a被证明能有效的提高动物模型中和临床实验中的心衰竭的关键性参数, 因此,miRNAs下调SRCA2a,心衰竭可能升高,心脏功能会受损。

为了找到心衰竭靶点miRNA,斯坦福大学伯明翰医学院及加州大学的老师发现因通过计算机算法预测了300多个靶向SERCA2a的miRNA,结果容易出错,需要进行经验评估,因此借助Vala 公司的KIC高内涵超高成像速度,逐孔单细胞鉴定分析的高通量分析技术,对全基因组中能下调钙离子泵的miRNA 做了筛选分析,同时对筛选到miRNA对钙的影响做了实时追踪分析,最终发现miR-25 通过下调SRCA2a导致心衰竭,抑制miR-25可以提高心脏收缩功能修复心衰竭,并将结果在Nature 的letter上发表文章《Inhibition of miR-25 improves cardiac contractility in the failing heart》
实验
利用Vala KIC超高速高内涵细胞分析系统筛选收集了整个基因组中可以选择性下调钙泵的整个miRNA库,筛选时将ERCA2a mRNA39 3’非编码区下游与增强型绿色荧光编码区融合,构建了一个靶向感应器用于检测miRNA的活性通过变低的eGFP的信号(Fig. 1a, b),通过Vala公司的KIC 高内涵分析系统超高成像速度及每孔逐个细胞的分析及统计功能进行筛选,结果显示144个miRNA减少了30%的荧光, P<0.05 (Fig. 1c, d),并且82个miRNA通过剂量测试被证实(Fig. 1e, f and Supplementary Table 1).,32个是进化保守,15个进化保守并且在心衰竭中上调,4个在HL-1心肌细胞中导致了显著的钙瞬时衰减的单尾方差延长,显示持续时间从75%到25%的最大值(CAD75—25),并且发现最有效的miRNA 是miR-25,其相对siRNA直接靶向SERCA2a, siSERCA2a, miR-25引发了显著的生理效应,并证实,miR-25在心衰竭的病人样本中表达上调,原位杂交显示miR-25主要表达在主动脉缩窄诱导的心衰竭心肌细胞中,在心肌纤维或血管外皮细胞中不表达,在血管平滑肌细胞中不表达(Fig. 2)。
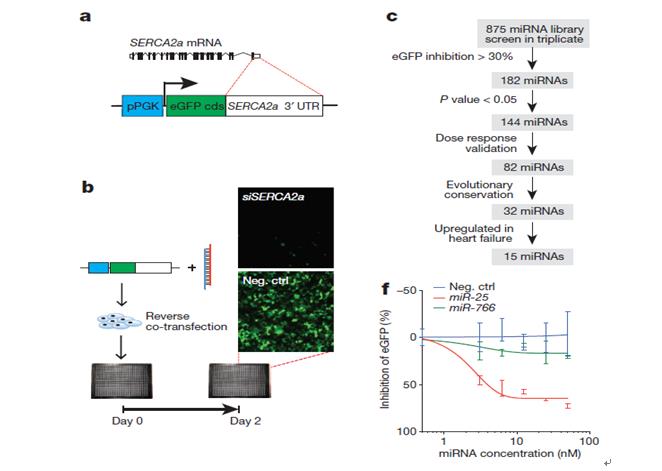
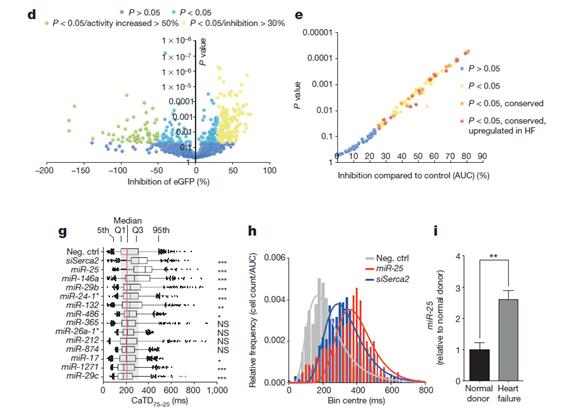
Figure 1 | High-content screening identifies miRNAs that control SERCA2a. a, b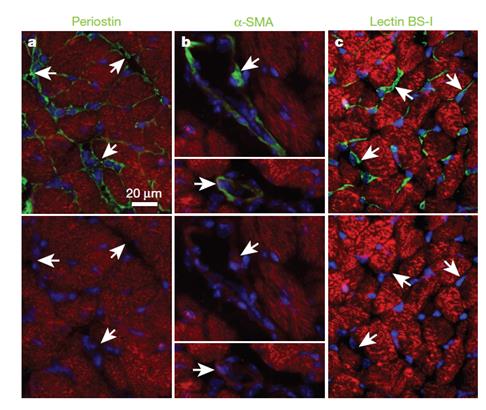
Figure 2 | Endogenous miR-25 expression in the heart
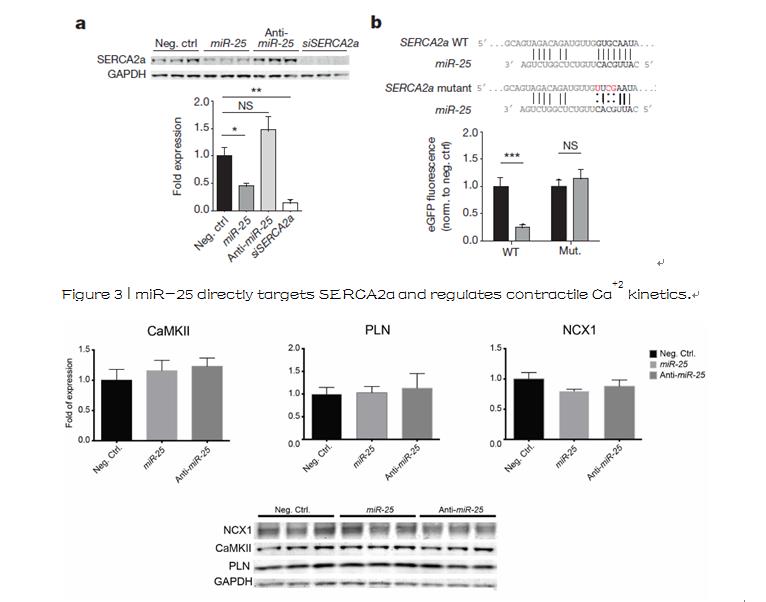
Extended Data Figure 2 | Effect of miR-25 on calcium handling proteins
已经显示miR-25能调节SERCA2a及IP3R1,之后利用Vala 的KIC高内涵分析系统,对培养了72小时的细胞,在1赫兹的情况下,加上5ms的15V电脉冲,在2秒时开始记录,以33fps的拍摄速度,对每个孔的单个细胞进行钙流实时拍摄, 测试了是否siRNA直接作用这些蛋白能够模拟体内miR-25对钙瞬时动力学的影响;结果统计发现,在新生大鼠心室心肌细胞和HL-1细胞中,相对自发的收缩,SERCA2a转染大大降低了瞬时(CaTD75–25)的衰减阶段(Ca2+重吸收),然而Ca2+瞬时向上的最大上升速率没有受到影响,精确地再现了miR-25的作用,并在从衰竭的人心脏中分离出的心室肌细胞中模拟出了1.5-2倍的衰减下降。在HL-1细胞,抗IP3R1的siRNA对Ca2+瞬时动力学影响非常小 ,而对NRVCS(CAD50、CAD75—25和Vmax )完全不影响,表明miR-25对Ca2+的瞬时动力学的调节主要是通过下调SRCA2a的表达实现,Vala KIC 高内涵精确的数据分析,科学准确的阐述了miR-25在心肌收缩过程中的机制,为心衰竭的治疗找到了靶点。
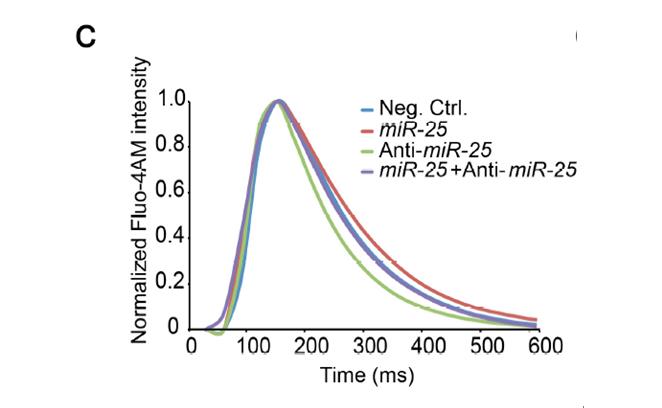
Extended Data Figure 1 | Effect of miR-25 on IP3R1 and cardiomyocyte calcium transients in vitro