自噬是真核细胞降解长寿蛋白、错误折叠蛋白和受损细胞器的重要生物学过程。细胞自噬由多个步骤组成, 其中包括: ① 吞噬泡的形成; ② 自噬体的形成; ③ 自噬体与溶酶体融合形成自噬溶酶体; ④ 自噬溶酶体的降解。自噬流是这些步骤在细胞内连续出现的动态过程, 自噬流中的任一环节出现障碍自噬将无法完成其生物学功能。自噬流的活化或受阻往往可以造成截然不同的生物学效应。在不同组织器官中自噬流的阻断往往导致致病蛋白、错误折叠蛋白及受损细胞器清除障碍, 进而通过诱导炎症等生物学效应引发多种疾病发病, 其中包括神经退行性疾病、肿瘤、肌肉病、心血管疾病、自身免疫病和组织纤维化等。由于自噬流是细胞内不断变化的一种动态过程, 因此通常在自噬流检测时存在诸多难点。可见熟悉自噬流快速、准确的检测方法是真正认识自噬生物学功能的关键。
1 微管结合蛋白1A/1B-轻链3 的检测
目前使用最为广泛的自噬流检测方法是通过Western blot 检测microtubule-associated protein 1A/1B-light chain 3B (LC3B) 蛋白表达水平, 但是如果没有自噬工具药作为对照, 则观察到的LC3B 改变无法真实反映细胞内自噬流状态。例如LC3B-II 增加既可能是自噬活化后自噬小体增多而成, 也可能是自噬溶酶体清除失败所致。自噬流的检测方法较为复杂,单独使用现有的某一种技术方法往往不能达到系统性检测自噬流, 因此需要选择多种不同实验方法, 综合评价其检测结果才能较为客观地反映细胞自噬流状态。
哺乳动物LC3B 基因的同源性可高达94%, 这体现了自噬体在生物进化当中的保守性和重要性。在哺乳动物细胞内LC3B 的总量通常不会有巨大波动,一般只会出现LC3B-I 和LC3B-II 间的相互转换, 或是由于自噬溶酶体降解而导致的LC3B-II 清除, 这些现象都间接反映了细胞自噬流的状态。通常认为在Western blot 实验中观察到LC3B-I 向LC3B-II转化, 或是LC3B-II 含量增多代表了自噬流的活化;LC3B-II 含量降低代表了自噬抑制。然而LC3B-II 的减少存在两种原因, 一为自噬流的阻断, 即LC3B-I无法向LC3B-II 转化; 二是自噬流过度活化, LC3B-II在自噬溶酶体降解消耗增多所致。这两种情况在Western blot 的检测中会得到类似的结果, 但却代表了截然不同的生物学终点。因此如何精确把握自噬流不同状态与LC3B 蛋白含量的关系是正确判断自噬流活化的关键。
1.1 使用自噬相关工具药物检测LC3B-I/II 转化
到目前为止伴随使用自噬晚期抑制剂, 通过检测LC3B-I/II 转化是自噬流检测的金指标。当使用自噬晚期抑制剂巴弗洛霉素A1 (bafilomycin A1, Baf A1)刺激细胞时, 细胞内自噬溶酶体降解被抑制, 此时观察到的LC3B-II 的变化仅代表自噬小体数量的改变。
当细胞自噬流活化后, LC3B-II 的含量会在使用Baf A1的基础上进一步增加, 而当细胞自噬流阻断后, LC3B-II 的含量则不会在使用Baf A1 的基础上发生改变。除Baf A1 外, 其他一些能提高溶酶体pH 值的自噬晚期抑制剂也可以用于自噬流的检测。若待检测药物+Baf A1 组LC3B-II 与仅Baf A1 处理组相比显著增加则代表所检测药物可以增加自噬小体或自噬溶酶体的合成。相反, 若处理组与对照组相比,LC3B-II 降低则代表处理药物减少自噬小体的合成。
通常在使用Baf A1 判断药物对自噬流影响时会设定4 个组别, A: 空白组 (未处理组)、B: Baf A1 处理组、C: 待测药物处理组、D: 待测药物与Baf A1联合处理组。A、C 组LC3B-I 向LC3B-II 转化代表了自噬小体的形成和自噬溶酶体降解的综合效应。而B 组和D 组则仅代表细胞自噬小体的合成水平。因此通过C 组与D 组比较可以部分判断待测药物对于自噬小体或自噬溶酶体降解的影响。若结果显示LC3B-II 含量A组< B组= C组= D组,则代表待测药物能够减少自噬体降解。由于LC3B-IIB 组= D 组, 因此说明待测药物不影响自噬体合成;LC3B-II A 组< C 组, 说明在不影响自噬体合成的情况下, 待测化合物能够抑制自噬体的降解。由此可见在待测药物仅影响自噬体降解时, LC3B-II C 组与D组并无差异 (图1A)。
若结果显示LC3B-II 含量C 组< A 组< B 组< D组, 则代表待测药物可增加自噬体的合成和降解。LC3B-II B 组< D 组说明待测药物可以增加自噬体合成; 在待测药物可以增加自噬体合成的前提下,LC3B-II 含量C 组< A 组, 说明待测化合物能够增加自噬体降解。综合评判, 待测药物能够加快细胞自噬进程 (图1B)。
若结果显示LC3B-II 含量A组< B组= C组< D组,则说明待测药物能够增加自噬体合成。LC3B-II B 组含量 < D 组, 说明待测化合物可以增加自噬体合成;在待测药物可以增加自噬体合成的前提下, LC3B-II含量A 组< C 组, 说明待测化合物可能抑制自噬体降解。此时需要比较C 组与D 组间及B 组与D 组间的LC3B-II 含量差别。若待测药物抑制自噬体降解则D组与C 组LC3B-II 含量之差应小于D 组与B 组之差;若待测化合物仅增加自噬体合成则LC3B-II 含量D组−C 组应等于D 组−B 组 (图1C)。
通常图1A 及1B 中的状况较好判断, 然而图1C情况则较为复杂。由于受Western blot 实验精度影响,很难准确计算两组间LC3B-II 含量的差值, 难免最终做出错误判断。因此仅判断待测药物是否促进自噬体合成较为容易, 若要同时检测其是否影响自噬溶酶体降解则需要更加谨慎的实验进行判断。

由于Baf A1 对于LC3B-II 的清除抑制极为显著,若待检测药物仅微弱调节自噬反应, 则在Western blot 检测时, LC3B-II 的改变可能会由于Baf A1 的效应无法判断。通常Baf A1 处理细胞4 h 已经能够完全阻断自噬, 而长时间 (>8~12 h) 饱和浓度的Baf A1刺激很有可能会影响泛素蛋白酶体降解功能。
除Western blot 外, LC3B 蛋白还可以GFP-LC3B等融合蛋白形式通过免疫荧光和流式细胞术等方法进行检测。这两种检测均需要使用荧光染料或荧光蛋白进行标记。免疫荧光的优势是可以观察到LC3B的点状聚集, 而流式细胞术则可以分析大量单细胞内LC3B 的表达水平。然而这两种方法均不能区分LC3B-I 和LC3B-II, 只能观察到LC3B 的总量。
1.2 应用GFP-LC3B 剪切实验评价自噬流
GFPLC3B融合蛋白不仅能够利用其荧光标签进行检测,还可利用溶酶体对标签蛋白的切割通过Western blot进行检测。GFP-LC3B 蛋白进入到自噬溶酶体内后LC3B 部分对溶酶体中的蛋白水解酶较为敏感, 较容易被降解。而融合蛋白中的GFP 部分则对于溶酶体中的蛋白水解酶敏感性较低, 不容易被降解。使用GFP 抗体进行Western blot 检测可能会检测到GFPLC3B-I、GFP-LC3B-II 和游离GFP 标签三个条带, 若出现游离GFP 标签条带则代表细胞自噬流活化。此外, 在检测同一细胞样品时还可以使用LC3B 抗体检测内源性LC3B-I 向LC3B-II 转化。值得注意的是游离GFP 标签的出现仅代表自噬流适度活化, 当自噬流过度活化时细胞内自噬溶酶体中的pH 值进一步降低, 其降解蛋白的能力进一步增强, 因此GFP标签蛋白也被逐渐降解消失。由此可见, 若观察不到游离GFP 标签, 则有可能是由于自噬流阻断, 也有可能是由于自噬流过度活化所致。当自噬流过度活化时, 若想要观察到GFP 标签条带则需要配合使用低浓度自噬抑制剂, 如氯化铵或氯喹。这些药物能中和溶酶体中的酸性环境, 又不完全抑制细胞自噬功能, 但当自噬流阻断时即使使用低浓度自噬抑制剂也无法观察到游离GFP 标签。
氯喹是一种常用的自噬抑制剂, 其可以通过提升细胞溶酶体内pH 值进而剂量依赖性阻断细胞自噬活性。使用低浓度氯喹处理GFP-LC3B 过表达细胞时仍可以观察到单独的GFP 标签条带。此现象并不是因为低浓度氯喹可以诱导自噬活性, 而是由于使用低浓度氯喹 (约10 μmol·L−1) 能够升高溶酶体中pH 值, 同时又可保留部分自噬活性, 进而使得LC3B降解所致。当氯喹浓度超过50 μmol·L−1 时, 自噬活性被完全抑制, 此时无法观察到GFP 标签条带。同理,低浓度Baf A1 (2.5 nmol·L−1) 处理细胞也可以观察到游离GFP 标签条带 (图2)。

雷帕霉素刺激和饥饿培养是最为常规的自噬流活化方法, 但两者在GFP-LC3B 的Western blot 检测中却可以观察到截然不同的结果。当使用雷帕霉素处理细胞或饥饿诱导自噬活化后LC3B-II 蛋白均发生降解。与饥饿不同, 雷帕霉素属于温和的自噬活化方式, 使用Western blot 检测可以观察到游离GFP 标签条带, 且雷帕霉素的这一现象具有一定的时间依赖性和浓度依赖性。而在使用EBSS 进行细胞饥饿培养后, 细胞需要大量内源性蛋白提供生存所需养分, 因此溶酶体中pH 值急剧下降, GFP 蛋白随即被降解,因此无法观察到游离GFP 标签条带。但无论使用雷帕霉素还是饥饿处理细胞, 使用LC3B 抗体均能够观察到内源性LC3B-II 的表达增加。
1.3 应用流式细胞术检测细胞内LC3 含量
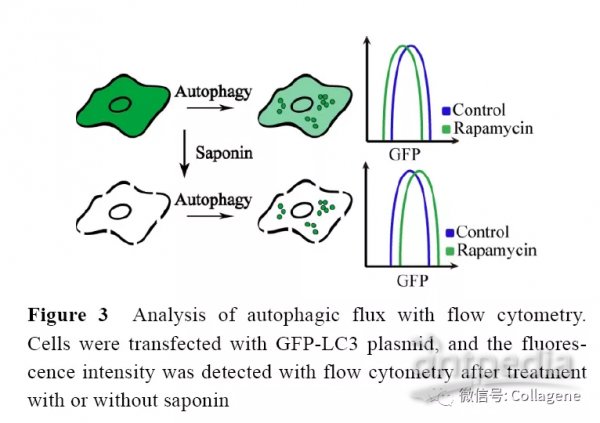
使用流式细胞术观察GFP-LC3 过表达细胞内LC3B 含量变化时通常观察LC3B 荧光强度的改变。当自噬流活化时, 细胞内LC3B-I 会向LC3B-II 进行转化, 定位于自噬体或自噬溶酶体膜表面的LC3B-II 将随着自噬的活化而逐渐降解, 因此在流式细胞仪上会观察到LC3B 荧光强度降低。但由于细胞本身自噬活化后LC3B-I 的产生也会增加, 因此LC3B 荧光强度降低并不十分明显。若要在流式细胞仪上观察到明显的荧光变化需要将待检测细胞进行破膜处理。流式细胞术可以将破膜后的细胞内游离型LC3B (LC3B-I) 与结合型LC3B (LC3B-II) 相区分, 这一点有助于判断细胞自噬流的状态。由于LC3B-I 是以游离形式弥散于细胞浆中, 细胞在经过皂素破膜后LC3B-I 会漏出到细胞外。而LC3B-II 主要结合在自噬体和自噬溶酶体膜表面, 即使破膜也不会漏出。自噬流活化时自噬体数量增加, 且自噬体和自噬溶酶体由于体积的关系, 无法通过皂素在细胞膜表面所制造的微孔。因此当细胞自噬流活化时, 经过皂素处理的细胞内荧光强度会增加 (图3)。但当使用自噬抑制剂Baf A1 处理细胞后, 由于大量自噬溶酶体无法得到清除, 在经过皂素处理后细胞荧光强度同样会增强。
1.4 串联荧光标签检测细胞内自噬流
除GFP 外,可以用于检测自噬流的荧光蛋白还包括mRFP 及mCherry 等。GFP 或EGFP 虽然对于溶酶体中蛋白酶的降解较为不敏感, 但其荧光在自噬溶酶体中容易由于pH 的降低发生淬灭。与绿色荧光蛋白不同,mRFP 或mCherry 对于溶酶体中的酸性条件并不敏感,当荧光蛋白本身没有被降解时, mRFP 或mCherry可以持续发出红色荧光。另一方面, mRFP 和mCherry的荧光强度和荧光稳定性也远高于GFP, 更易于进行免疫荧光检查。由此可见, 将绿色荧光蛋白及红色荧光蛋白串联在一起可利用两者在溶酶体中敏感性的不同, 观察并判断细胞自噬流状态。
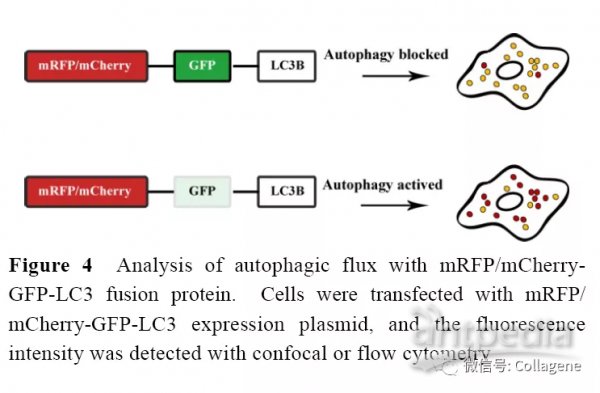
mRFP/mCherry-GFP-LC3B 串联荧光蛋白是专门用于检测自噬流水平的融合蛋白, 自噬活化时GFP荧光信号在进入溶酶体后由于pH 值的下降会出现淬灭, 但是mRFP 或mCherry 荧光基团的pH 值稳定性比GFP 高, 在进入自噬溶酶体后仍能发出荧光。因此在使用mRFP/mCherry-GFP-LC3B融合蛋白进行细胞实验时, 同时观察红色荧光和绿色荧光的强度变化可以准确判断细胞自噬活性。若细胞内出现绿色荧光和红色荧光共定位, 即出现黄色荧光时表明mRFP/mCherry-GFP-LC3B 融合蛋白并未与溶酶体发生融合或自噬溶酶体中的pH 值较高, 进而代表了自噬流的阻断。当细胞内仅出现红色荧光而无绿色荧光时,代表mRFP/mCherry-GFP-LC3B融合蛋白定位于溶酶体或自噬溶酶体内, 即自噬流活化。免疫荧光显微镜或活细胞工作站是观察mRFP/mCherry-GFP-LC3B融合蛋白的最佳仪器, 特别是活细胞工作站可以动态观察细胞内荧光颜色的变化, 更加确凿地证实细胞自噬过程。使用mRFP/mCherry-GFP-LC3B 串联荧光蛋白的最大优势在于, 仅通过荧光强度的改变就可以判断自噬流状态, 而不需要其他任何自噬工具药物参与。转染mRFP-GFP-LC3B 质粒后的细胞经饥饿处理, 会出现黄色荧光和红色荧光均出现点状聚集的现象, 其中黄色荧光的增加是由于自噬小体数量增多导致的, 这一点与GFP-LC3B 过表达细胞内的绿色荧光点状聚集相类似。目前串联荧光这一技术也被用于进行自噬调节剂的药物筛选, 通过细胞组学显微镜可以同时观察至少1 000 个细胞的荧光强度, 进而达成高通量筛选的目的(图4)。
前文所述, 在使用Western blot 进行GFP-LC3B细胞自噬活性检测时, 使用低剂量氯喹刺激细胞可以检测到游离GFP 标签蛋白条带。同理在进行mRFP/mCherry-GFP-LC3B 融合蛋白检测实验时, 低剂量氯喹或Baf A1 部分抑制自噬后溶酶体内pH 值升高,因此在抑制溶酶体活性的同时还可以造成细胞绿色荧光淬灭及红色荧光聚集现象。若使用高剂量或饱和剂量氯喹或Baf A1 刺激细胞时细胞内黄色荧光明显增加, 但绿色荧光淬灭并不明显, 因此当绿色、红色荧光合并后细胞内的红色荧光强度很低。这种现象代表高剂量自噬抑制剂造成的自噬流阻断完全抑制了GFP 荧光的淬灭和其蛋白的降解, 可见自噬流活化和部分自噬阻断都可以检测到红色荧光强度增加的现象。两者之间的区别在于自噬流活化引发的红色荧光强度要高于部分自噬阻断时细胞内的荧光强度。鉴于以上两种情况时黄色荧光点状聚集均增强, 可以通过计算每个细胞内红色荧光点的百分比来确定自噬流状态。若红色荧光点百分比与对照相比增加, 则代表自噬流活化; 若红色荧光点数量增加, 而百分比没有明显变化, 且黄色荧光点数量同样增加, 则代表自噬流受到部分抑制; 若红色荧光点百分比下降则代表自噬流阻断。上述荧光点百分比可通过专业影像学软件进行分析并计算, 首先统计细胞内平均荧光点总数 (X), 随后统计细胞内平均红色荧光点总数(Y), 则Y/X 值显示了细胞自噬流状态。Y/X 值越高表明自噬流活性越强, Y/X 值越低则表明自噬流阻塞越严重。
转染mRFP/mCherry-GFP-LC3B的细胞除利用免疫荧光显微镜观察细胞内荧光分布外, 还可以通过流式细胞术对其进行分选。利用分选软件将每个细胞内mRFP 或mCherry 的发射光强度与GFP 发射光强度进行比值处理, 比值高的细胞代表高自噬流活性;比值低的细胞代表低自噬流活性。通过分选可以获得一个细胞群中高自噬流活性的细胞亚群和低自噬流活性的细胞亚群。然而某一细胞内的自噬流活性并不是固定不变的, 分选所得高自噬流活性细胞群和低自噬流活性细胞群在静息一段时间后, 其细胞内荧光比值会向中值偏移, 这种现象充分代表了自噬流是一种动态的过程。通常的实验手段仅能够检测到自噬流的某一状态, 要想充分评价自噬流变化需要动态观察细胞内的自噬活性。可见在活细胞工作站下长时间观测mRFP/mCherry-GFP-LC3B融合蛋白细胞内荧光强度变化是评价自噬流的良好选择。目前mRFP/mCherry-GFP-LC3B 转基因小鼠也可用于体内自噬流检测, 将转基因小鼠的组织进行冰冻切片染色能够很好地评价待检测药物在体内对于自噬流的调节作用并观察这一作用的组织特异性。
2 SQSTM1/p62 结合LC3B 蛋白翻转实验评价自噬流
自噬底物的清除必须要经过两个步骤, 一是自噬对于待降解底物的识别, 二是将待降解底物转运至自噬溶酶体。这两个步骤是自噬流活化与否的关键,而自噬货车蛋白恰恰是操控这些步骤的关键因素。p62 是选择性自噬最重要的货车蛋白, 其也被称之为选择性自噬受体, 它是连接LC3B 与待降解泛素化底物的桥梁。p62 结合泛素化蛋白进入到自噬体后最终与溶酶体融合形成自噬溶酶体从而得到清除。自噬流抑制时p62 含量增加, 相反自噬流活化时p62 水平下降。p62 Ser403 位磷酸化可调控自噬对泛素化蛋白的清除, 此现象可通过抗磷酸化p62 抗体检测。当某些Atg 基因缺失或自噬体与溶酶体融合受阻时,p62 会显著性堆积。此外p62 还可以作为载体将待降解蛋白带入蛋白酶体内进行降解, 但总体来说其自噬调节作用更为重要。
通常检测p62 蛋白时应当选择观察内源性蛋白,因为在细胞内过表达p62 会造成p62 蛋白包涵体样堆积。当自噬流受阻时, 内源性的p62 也会出现不可溶性堆积, 且这种聚集体是Triton X-100 不可溶的。此外p62 还参与了蛋白酶体降解过程, 当蛋白酶体降解系统受阻时p62 含量同样增加。在研究p62 蛋白降解速率时, 应当适当使用蛋白酶体降解系统抑制剂来观察自噬对于p62 蛋白的降解; 构建带有诱导型启动子的EGFP-p62 也可以用来单独评价其蛋白的降解;通过放射性同位素法也能评价p62 蛋白的降解。然而,当自噬流活化时也有可能观察到p62 含量增加的现象,这是由于自噬体和自噬溶酶体数量代偿性增加的原因, 因此不能单独通过p62 的表达来确定自噬活性。
在操作过程中, 通常可同时观察可溶性p62 蛋白、不可溶性p62 蛋白和LC3B-I/II 转化综合判断自噬流状态。若是可溶性p62 蛋白减少, 不可溶性p62无明显改变, 同时LC3B-I 向LC3B-II 转化增加则表明自噬流活化; 若观察到可溶性p62 蛋白减少, 但不可溶性p62 明显增加, 则无论LC3B 是否发生I 型向II 型的转化均代表了自噬流阻断; 即使可溶性p62 蛋白水平降低, 不可溶性p62 无明显改变, 但LC3B 没有发生I 型向II 型的转化, 也不能说明自噬流一定活化。获取不可溶性p62 的方法主要是在常规细胞裂解离心后, 向离心沉淀中加入高浓度尿素或盐酸胍, 使形成包涵体的不可溶性p62 溶解, 随后便可使用常规蛋白质电泳进行检测。
需要注意的是, 当自噬流出现波动时可溶性及不可溶性p62 的变化具有一定的滞后性, 这也为其检测造成了一定困难。LC3B 在自噬流出现活化或抑制时, 其蛋白水平改变较为迅速, 而作为自噬底物, p62降解所需时间则较长。在检测过程中设定不同的时间点可以动态分析p62 的变化。假定经过药物处理后6 h 或24 h 能够观察到LC3B 蛋白水平变化, 则p62的蛋白水平改变可能需要等到24 h 或48 h 才会出现,但也有可能与LC3B 同时出现改变。
另一种检测p62 的方法是在使用或不使用自噬抑制剂的情况下通过免疫染色进行分析, 这样做可以观察到弥散型p62 和聚集型p62 的分布。目前通过检测p62 判断自噬流最为准确的方法是联合Western blot 和免疫染色技术, 包括免疫组化和免疫荧光。一方面可以检测到细胞内p62 不同形态的含量变化, 另一方面可以观察不同形式p62 在细胞内的定位。总体来说, LC3B-II 的增加与p62 的降低并不具有一致性,要想正确评价自噬流受阻或自噬系统受损应当检测LC3B 的转化, 也要检测可溶性和不可溶性p62 的变化。
3 长寿命蛋白的自噬性降解
细胞内蛋白质主要通过两条途径来降解, 即蛋白酶体途径和自噬途径, 其中蛋白酶体途径主要负责短寿命蛋白的降解, 而长寿命蛋白和部分细胞器则主要通过自噬途径降解。近年来, 越来越多的研究者意识到单纯观察自噬溶酶体的数量不足以判断自噬流的变化, 而检测长寿命蛋白的降解则可以很好地评价自噬流的改变。细胞自噬作为广泛存在于真核细胞内的一种溶酶体依赖性的降解途径, 其活化涉及到自噬体的形成、自噬底物的转运及其在自噬溶酶体中的降解等多个过程。在饥饿或应激条件下, 自噬可以有效调节胞内长寿命蛋白以及关键细胞器的降解, 为细胞对抗应激、细胞免疫和发育以及组织重塑提供物质基础; 在病理状态下, 自噬流受阻或过度活化则会导致长寿命蛋白的异常降解, 从而导致细胞正常功能和形态无法维持, 细胞稳态被打破, 促使组织器官的功能进一步恶化。
观察自噬蛋白降解是较早建立的一种自噬动态定量分析方法, 测定一般是利用放射性氨基酸掺入细胞蛋白并通过检测放射性标记氨基酸来定量蛋白降解。首先需要将同位素标记的氨基酸 (通常是14C 或3H 标记的亮氨酸或缬氨酸或35S 标记的甲硫氨酸) 与培养细胞共孵育数小时乃至数天, 通过洗涤细胞清除未进入细胞的放射性物质, 再使用无同位素标记的氨基酸与细胞共孵育较短时间 (通常为1 h, 某些细胞此步骤可能延长至24 h), 待蛋白酶体将短寿命蛋白迅速降解后, 更换饥饿培基HBSS 或EBSS 诱导自噬活化继续培养4 h, 期间也可以加入3-methyladenine(3-MA) 抑制自噬小泡的形成, 从而实现对细胞自噬的抑制。最终在细胞中加入三氯乙酸后检测培养上清中的同位素及细胞中的同位素, 上清中同位素与沉淀细胞中同位素的比值即长寿命蛋白的降解率。
此方法具有较高的敏感性但特异性较低, 无法区分自噬依赖性降解和非依赖性降解, 因此通常需要加入溶酶体拮抗剂, 如氯喹、氯化铵和Baf A1, 通过分析添加拮抗剂前后同位素标记氨基酸的释放情况来考察此方法的特异性。除此之外, 若细胞在自噬流活化后, 长寿命蛋白降解产生的氨基酸不排出到细胞外, 而在细胞内重新合成或产能则会导致最终的实验结果出现偏差。
4 小结
自噬流检测是评价细胞自噬是否行使正常功能的重要途径, 但在自噬流的检测过程中往往由于存在技术稳定性差、检测手段单一、缺乏良好对照等情况, 使得实验人员难以获得真实可靠的结果。在本文中作者主要介绍了通过Western blot、流式细胞术和免疫荧光等方式检测LC3B-I/II 的转化以及细胞定位;自噬货车蛋白p62 的检测方法; 长寿命蛋白自噬性降解的检测。这些方法均可用于观察细胞内自噬流的变化, 但任何一种手段都有其局限性, 若要客观评价细胞自噬流状态最好选择多种方法综合评定, 例如联合使用Baf A1 参与的LC3-I/II 转化实验和RFPGFP-LC3 串联荧光法判断自噬流就是较为恰当的方式。此外足够的实验重复次数、适当的实验对照也是正确检测自噬流的关键。