微管(Microtubule)是抗肿瘤药物研发的重要靶点。微管是“细胞的骨架”主要成分之一,在许多细胞重要事件中起着关键作用。微管是由α-和β-微管蛋白(Tubulin)异二聚体可逆地组装成而成的线性管装结构(图1)。
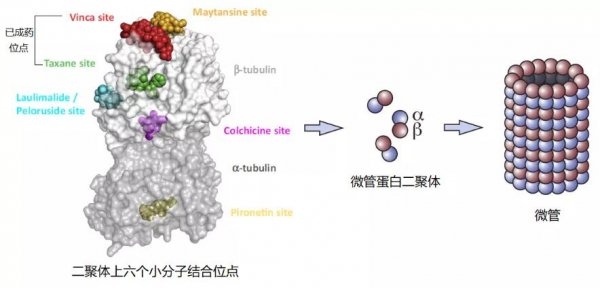
图1:微管蛋白已知的六个结合位点及微管蛋白组装形成微管示意图
目前,微管蛋白已有6个结合位点被报道,除结合在α微管蛋白pironetin外,其余5个均在β微管蛋白上,分别为长春花碱、秋水仙碱、紫杉醇、laulimalide 和美登素,它们都与 β-微管蛋白结合并干扰其正常动力学过程从而抑制微管蛋白的聚合或解聚。其中,靶向β-微管蛋白的紫杉醇、长春新碱代表了当今最成功一线抗肿瘤化疗药物,其中紫杉醇在全球销售额已经超过300亿美元。但由于β亚基具有 GTP 酶活性导致其构象不稳定,从而先天性决定了现有的结合于β亚基的抗微管药物均容易产生耐药性。与β亚基相反,α亚基没有 GTP 酶活性,不易发生构象变化,这类新型的靶向α-微管蛋白的药物很可能不受 β-微管蛋白的突变及 βIII-微管蛋白的高表达所影响,从而可以克服耐药。因此,开发靶向 α-微管蛋白的药物对克服化疗药物耐药具有巨大开发价值。
近日,四川大学华西医院生物治疗国家重点实验室陈俐娟研究员团队在Science Advances的发表题为Cevipabulin-tubulin complex reveals a novel agent binding site on α-tubulin with tubulin degradation effect。研究解析Cevipabulin-微管蛋白复合物晶体结构,发现了一个促降解微管蛋白降解的药物结合位点。

四川大学华西医院生物治疗国家重点实验室陈俐娟课题组一直从事靶向 α-tubulin 抑制剂的开发, 该课题组于2016年首次发现了位于α微管蛋白上的Pironetin位点,相关文章发表在Nature Communications杂志(Nature Communications 2016, 7 : 12103)。这次该课题组又在α微管蛋白上发现了一个全新的、且能导致微管蛋白降解的结合位点(图2)。该位点被首次命名为第七位点。
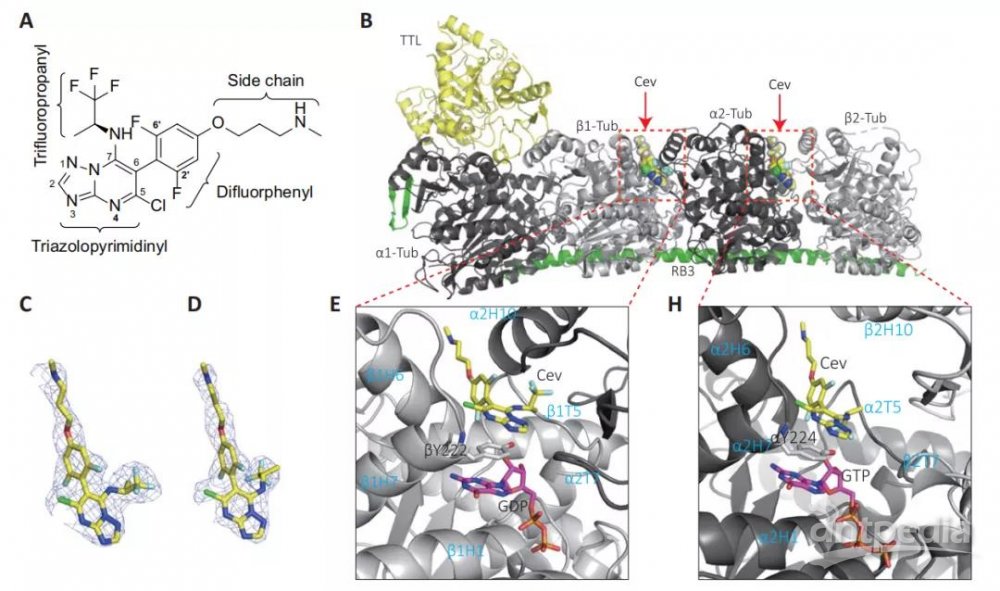
图2:Cevipabulin-微管蛋白复合物晶体结构。(A) Cevipabulin的化学结构图。(B)Cevipabulin与微管蛋白复合物结合的整体视图。(C) Cevipabulin在β1-微管蛋白上的FO-FC密度图。(D) Cevipabulin在α2-微管蛋白上的FO-FC密度图. (E) Cevipabulin在β1-微管蛋白上的局部视图(H) Cevipabulin在α2-微管蛋白上的局部视图。
如图2H所示,该第七位点位于αβ二聚体的内界面上, 由β2H10,α2T5, α2H6, α2H7和α2H1包裹形成。小分子Cevipabulin与第七位点结合后能够促进微管蛋白降解, 这是传统微管蛋白抑制剂所不具有功能。深入的机制发现Cevipabulin能够导致微管蛋白变性(图3A-3C)。从结构生物学上分析发现Cevipabulin结合到第七位点后能够导致αT5 loop环外移导致了原本此处的不可交换GTP变得可交换(图3D-3F), 从而破坏了微管蛋白的稳定性。
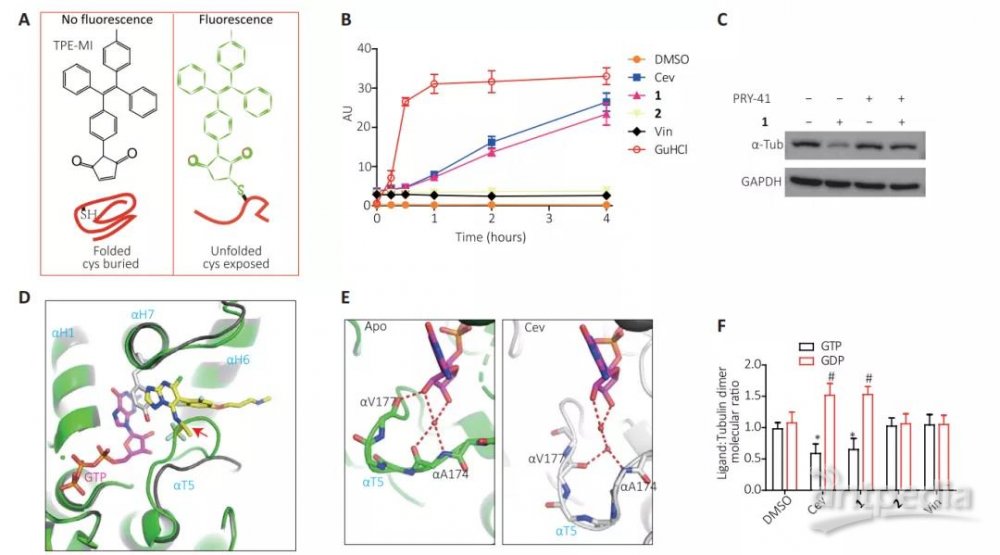
图3:Cevipabulin结合第七位点导致微管蛋白稳定性下降而促进其降解. (A) TPE-MI蛋白变性指示剂原理图。(B) Cevipabulin促进微管蛋白变性。(C)泛素化抑制剂PYR-41抑制cevipabulin衍生物1导致的微管蛋白降解。(D)Cevipabulin的结合导致α-T5的外移(E)cevipabulin结合后破坏了不可交换GTP与α-T5的氢键相互作用。(F) Cevipabulin结合导致不可交换GTP变得可交换。
相比较于该课题之前发现的pironetin位点,该位点结合的先导小分子Cevipabulin结构简单、且药代动力学数据好。具有更好的成药性。同时,第七位点具有微管蛋白降解的效果,为后续开发特异性的微管蛋白降解剂奠定了基础。
华西医院陈俐娟研究员、李为民教授及杨建洪助理研究员为该文章共同通讯作者。杨建洪助理研究员、余亚梅副研究员,黎勇博士后及闫伟博士后为共同第一作者。

