基因疗法是广受关注的创新治疗平台,而作为递送基因的有力手段,AAV载体平台的研发也在出现指数型增长。AAV载体有非常显著的优势,如安全性、长效性、多种血清型等,这都使AAV载体在基因治疗中迅速崛起。本篇行业研究从AAV载体概述、制备与质控、策略与应用、国内外企业等方面展开,详细介绍了AAV病毒包装CRO行业发展情况。
01
病毒载体概述
1.1 基因治疗简介
基因治疗,指将遗传物质转移到患者细胞内发挥作用,以达到治疗疾病的目的。根据其作用方式,基因治疗的策略可分为以下几种:①基因表达,②基因沉默,③基因编辑。
不管是哪种作用方式,理想的载体是基因治疗成败的关键,它们应该具备以下几个特点:有足够的空间来递送大片段的治疗基因;具有高转导效率,能感染分裂和非分裂的细胞;能靶向特定的细胞,且可以长期稳定表达转基因;具有较低的免疫原性的或致病性,不会引起炎症;具备大规模生产的能力。
目前基因治疗的载体一般分为病毒和非病毒载体。其中病毒载体是基因疗法最常用的递送系统(主要包括ADV、RV、AAV等),目前美国FDA已批准上市的基因治疗药物皆使用病毒载体。

1.2 常用载体
(1)病毒载体,主要包括腺病毒、腺相关病毒慢病毒等。
(2)非病毒载体,主要包括裸露DNA、脂质体、纳米载体等。
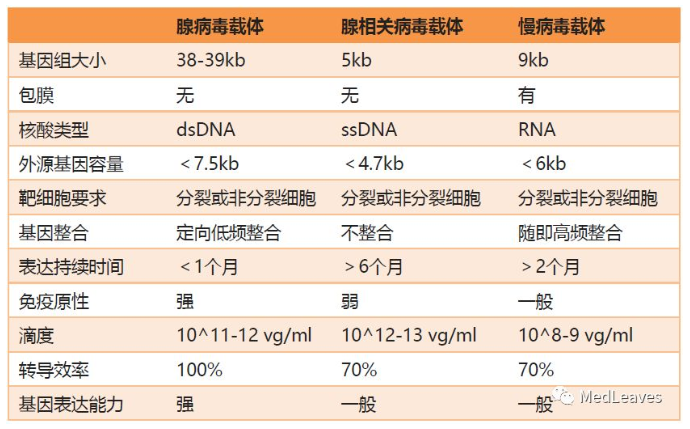
表 几种常用的病毒载体特点
02
腺相关病毒(AAV) 载体概述
2.1 AAV结构
腺相关病毒(AAV)是目前广泛使用的基因治疗载体,它是一种无包膜单链DNA病毒,属于细小病毒家族。许多哺乳动物包括人体内都能分离到各种血清型的AAV病毒。大多数成年人都感染过AAV病毒,但尚未发现该病毒是任何疾病的致病因素。它由蛋白衣壳(capside)和长度为4.7 kb的单链DNA基因组构成。
目前己发现其有12种亚型及120多种变型,并逐步用于重组AAV (rAAV)基因药物研发。作为基因疗法载体的重组腺相关病毒(rAAV)携带的蛋白衣壳与野生型AAV几乎完全相同,然而衣壳内的基因组中编码病毒蛋白的部分被删除,取而代之的是治疗性转基因(transgene)。AAV基因组中唯一被保留的部分是ITRs,它起到指导基因组的复制和病毒载体组装的作用。将编码病毒蛋白删除,一方面可以最大化重组AAV携带转基因的容量,另一方面可以减小病毒载体的免疫原性和细胞毒性。
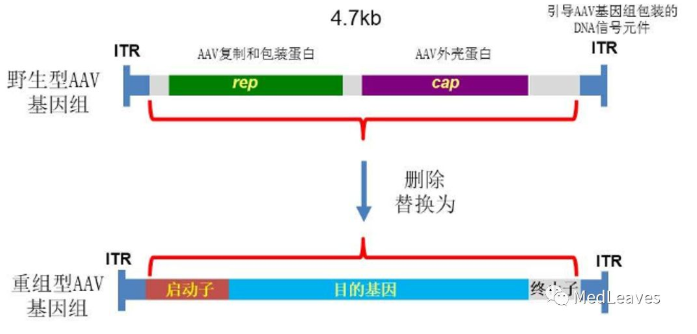
图 野生型与重组型AAV
2.2 AAV的侵染过程
重组AAV颗粒通过与宿主细胞表面表达的糖基化受体相结合,通过网格蛋白(clathrin)介导的内吞作用进入细胞。在内吞形成的内体(endosome)酸化之后,病毒衣壳的VP1/VP2部分构象发生变化,导致病毒从内体中脱离,并且通过核孔进入细胞核。进入细胞核后,单链DNA从衣壳中释放出来。单链DNA可以利用宿主细胞的DNA聚合酶来合成互补链,或者两条从不同AAV颗粒中释放的互补链退火(annealing)形成双链DNA。双链形式的AAV基因组然后利用ITRs进行分子内或分子间基因组重组,这一过程让AAV基因组成为稳定的游离DNA(episomal DNA),导致基因组能够在不再进行有丝分裂的细胞中持续进行基因表达。
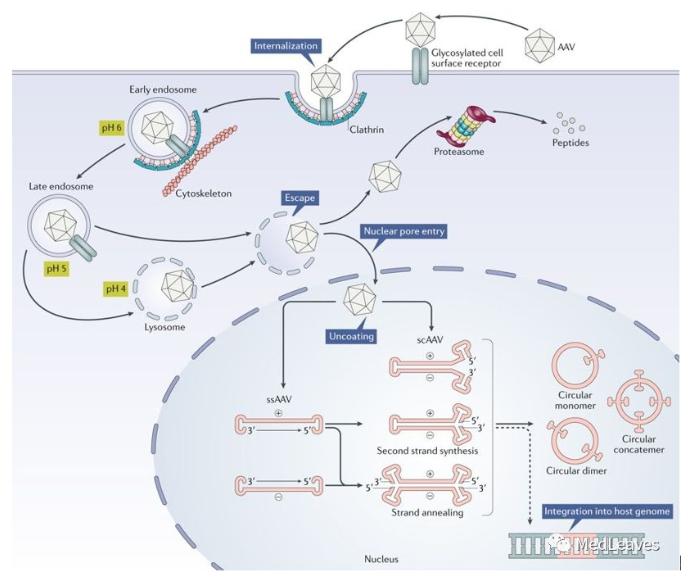
图 AAV的侵染过程
2.3 腺相关病毒(AAV)的发展史
90 年代中后期,伴随着人类基因组研究的迅猛发展,基因治疗领域呈现爆发性扩张。1999年,18岁的美国男孩格尔辛格参与了美国宾夕法尼亚大学James Wilson领导基因治疗项目并接受腺病毒载体注射,4 天后,格尔辛格因多器官衰竭死亡。这让基因治疗不论从社会舆论、国家政府资助、民间资本还是学术界角度都进入寒冬。经历过这次惨痛教训之后,人们逐渐开发出更安全有效的病毒载体。2002年,James Wilson又开发了重组AAV2/8 系统能高效靶向肝脏细胞,自此,AAV病毒载体进入蓬勃发展时期。

rAAV基因药物具有低毒性、低免疫原性、能介导外源基因长期表达等优点,在癌症、纤维化、糖尿病、血友病等众多疾病中具有良好应用前景。世界范围内己完成或正在进行的rAAV基因药物临床研究有170余项,其中在Leber's先天性黑内障的治疗中取得的巨大成功。
2012年11月2日,以1型AAV为载体表达脂蛋白脂酶的药物Glybera被欧盟正式批准上市,但后来于2017年退市;RPE65基因治疗药物(商品名Luxturna,美国Spark公司)2017.12.20 获得美国FDA批准上市,这是美国第一个利用腺相关病毒(AAV)作为载体,体内直接用药,用于治疗“基因缺失遗传病”的基因治疗药物。这些激发了rAAV基因药物的研发热潮。
2019年5月24日,美国FDA批准基因治疗产品索伐瑞韦(Onasemnogene abeparvovec-xioi,商品名Zolgensma)用于治疗小于2岁SMA儿童,这是最严重的SMA类型且是一种导致婴儿死亡的基因病因。该药也是美国历史上最贵的药。
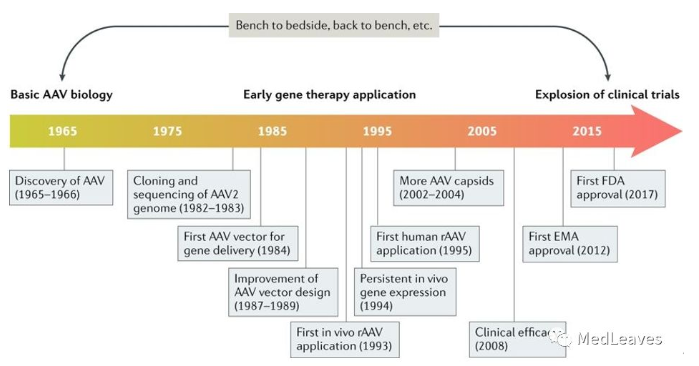
图 腺相关病毒(AAV)发展史
2.4 腺相关病毒载体在基因治疗中迅速崛起
AAV病毒载体拥有其他病毒载体无法比拟的优点,具体如下:
1. 多种血清型:不同血清型的AAV具有不同的组织器官靶向性。通过修饰、突变AAV的外壳蛋白序列产生新的组织倾向性的AAV血清型,目前文献中已经存在数千的突变型血清,具有极广的可选择性。目前临床常用的有AAV1,AAV2, AAV5, AAV6, AAV7, AAV8 和 AAV9 等。
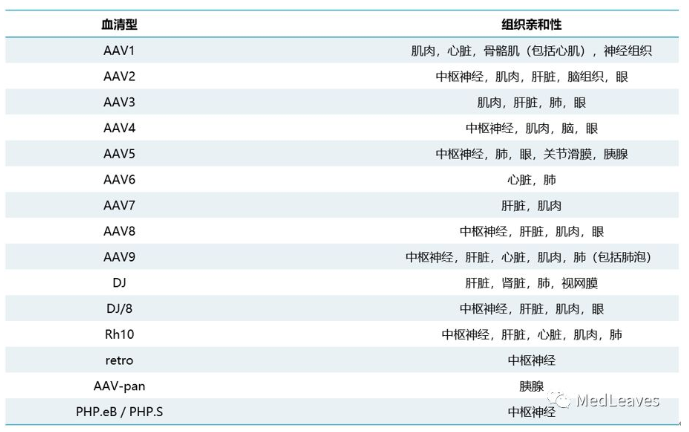
表 不同血清型AAV的组织亲和性
2.安全性高:ITR 序列和 rep/cap 基因分别由独立的质粒表达;未发现 AAV 对人体致 病,rAAV 去除了wtAAV 基因组的96%,进一步保证了安全性;免疫源性低,肝毒性低,可大剂量静脉、脑组织、血管介入注射,适合全身性组织器官细胞基因修饰。
3.长效性:长时程基因表达,治疗效果持久,甚至可以治愈。AAV目前在动物身上的实验表明,一次注射后其效果可以维持数年,可能是最为长效的基因治疗载体。
4.易于纯化,常用的方法有超速离心纯化、使用亲和层析柱纯化、IEX载体纯化等;可大规模标准化制造,可按照GMP标准管理。
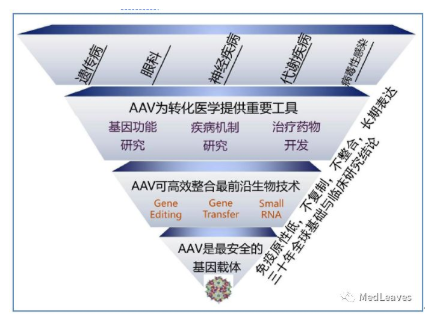
图 腺相关病毒载体在基因治疗中迅速崛起
03
重组腺相关病毒(rAAV)制备
3.1 rAAV载体制备的常用方法
rAAV的复制需要有三个方面的元件:1. 辅助病毒如Adenovirus的多个辅助因子;2.AAV自身的复制蛋白Rep2及外壳蛋白CapX;3. 在两端带有能自退火形成'T'字形的回文重复序列(Inverted Terminal Repeat,ITR)的基因组。目前常用的rAAV载体制备方法如下:
3.1.1 三质粒共转染293细胞
AAV生产采用最多的就是经典的三质粒共转染法(Helper-free AAV包装系统)。首先构建并纯化获得三个细菌质粒VEC,CAP和REP,其中VEC携带插入的基因,CAP和REP为构建AAV组成部分。再共转染到含有腺病毒Adenovirus的E1a/b元件的HEK293细胞,细胞内组装成为rAAV。其优点是只需要构建含目的序列的rAAV质粒和普通的转染过程,快速、简便、病毒空壳率相对低,是自该方法发明以来使用最广泛的rAAV生产方式。缺点是由于是基于贴壁细胞基础上的生产,细胞扩大化生产会有较大困难,目前已有模化临床应用的生产采用驯化出悬浮培养的293细胞,作三质粒共转染生产。这种制备方法需要制备大量高质量的载体质粒,rAAV的产量在很大程度上取决于转染的效率。已获批上市的治疗先天性黑朦病药物Luxturna即由Spark Therapeutics使用该方法开发。
3.1.2 用BEVs载体感染Sf9昆虫细胞进行rAAV生产
用杆状病毒Baculovirus携带Rep/Cap基因及ITR基因组,去感染悬浮培养的SF9昆虫细胞,可以包装出rAAV。该系统可通过穿梭载体灵活装载外源基因的片段,并在细菌内高效重组到杆状病毒基因组上,再将抽提出的重组杆状病毒基因组DNA经转染Sf9昆虫细胞,产生有感染活性的重组杆状病毒。然后,利用重组杆状病毒(BEV)感染悬浮培养的Sf9细胞生产rAAV,该方法的应用目前也较为广泛,上市药物Glybera就是用的这种方法。

3.1.3 稳定细胞株生产
建立起含有rAAV的Rep/Cap基因或ITR基因组的稳定细胞株(常用Hela细胞),再用辅助病毒来感染生产出rAAV。
此方法的优点是所用细胞可选能作悬浮培养的工业化生产细胞株,适合临床规模生产。缺点是稳定细胞株的建立与鉴定需要很长时间;细胞株需要注意多次传代后的稳定性;后续纯化过程中要注意完全失活辅助病毒。
3.2 rAAV大量制备和质控体系的建立
rAAV因其独特的优势,在基因治疗领域应用广泛。但其在临床应用上面临两个问题:一是rAAV药物的大量制备;二是rAAV基因药物的质量控制体系的建立。
rAAV大量制备就需要大量的高质量原材料质粒DNA。因此需要建立大规模生产质粒DNA的简单经济的纯化工艺和质控体系。基因治疗病毒载体的质量控制体系最重要的是病毒基因组的滴度。基因组滴度与基因治疗的效果密切相关,同时还决定着病毒载体使用的剂量。
3.2.1 质粒DNA的纯化与质控
3.2.1.1 质粒DNA纯化
纯化质粒DNA的难度有①其在大肠杆菌提取物里的含量很低,只有不到1%;②大多数主要杂质与质粒DNA存在相同的性质,如:负电荷(RNA,基因组DNA碎片和内毒素)、分子量(基因组DNA碎片,内毒素)、疏水性(内毒素),这些杂质的性质严重限制了质粒DNA的分离和纯化。而杂质的存在会引起人体的毒性反应,如蛋白质会引起免疫反应,过量的内毒素会导致中毒性休克等。
因此,美国FDA对临床应用的质粒DNA制订了如下质量要求:RNA<1%,细菌基因组DNA含量<10ng/mg,杂蛋白含量<5 ng/mg,内毒素<40 Eu/mg。质粒DNA中需要除去的杂质成分复杂且性质相似而难以全部除去干净。其中,很多方法难以用于治疗质粒DNA的纯化的主要原因是RNA残留和回收率低的问题。RNA因数量大,性质与DNA极其相似而难以去除。
3.2.1.2 质粒DNA质控
质粒DNA是rAAV制备的原材料,其纯度及生物活性直接影响rAAV制备的质量,同时质粒DNA大规模的制备能为rAAV大量的制备提供充足的原材料。质粒纯化方法有:色谱法、磁微粒法、双水相系统(ATPS)、膜分离法;质粒质控方法有:凝胶电泳、BCA蛋白检测试剂盒、内毒素检测试剂盒和qPCR对所纯化的质粒DNA的纯度进行检测。同时,通过细胞及动物转染实验对纯化的质粒DNA的生物活性进行检测。
3.2.2 包装的细胞系的大量制备
在生产rAAV的过程中,不同的生产策略需要相应的宿主细胞。因基因组内已整合有Ad的Ela和Elb基因,且用磷酸钙转染的效率较高,实验室最常用的多质粒转染法的宿主细胞是HEK293细胞。另外,以HEK293细胞为基础建立的稳定转染细胞系也多有报道。但是,HEK293为贴壁培养细胞,若要大量生产,需要将其驯化成悬浮培养细胞。
HeLa和A549细胞基因组内不含EIa、Elb基因,是制备具有高稳定性和高生产率的细胞系的常用细胞。但利用这些细胞系生产rAAV载体很难摆脱辅助病毒共感染这一限制性步骤,因而辅助病毒污染成为其主要缺点。
幼地鼠肾细胞(BHK细胞)也可被用于生产rAAV,但BHK细胞的非人源性限制了其在rAAV生产中的应用,目前仅在HSV杂合病毒生产rAAV的系统中以BHK细胞作为宿主细胞。
草地贪夜蛾(Sf9)细胞作为rAAV生产的宿主细胞也是近年研究的热点。以Sf9作为宿主细胞有以下优势:多角体蛋白启动子或p10启动子的活性使其能够高水平表达Rep,Cap蛋白;能够无血清悬浮培养,容易扩大规模;如同在哺乳动物细胞中一样,Sf9细胞能对蛋白进行翻译后修饰,保留蛋白的生物学功能,且Sf9细胞的安全性也已被确认。以Sf9为宿主细胞的杆状病毒生产系统是目前最大规模的rAAV生产系统。但昆虫细胞毕竟不是AAV多年进化后所选择的宿主细胞,在其中包装制备rAAV往往具有天然的缺陷。
3.2.3 rAAV产品的质量控制
常用的rAAV上游生产方法都可能在每个生产平台的起始材料(输入)及可能在终产物(输出)中出现的相关杂质。rAAV储液中最常出现的杂质包括缺陷型颗粒(即不含治疗性基因和不具感染性的AAV衣壳)、来源于宿主细胞和辅助病毒(腺病毒、单纯性疱疹病毒或杆状病毒)的残留蛋白以及可能包封进rAAV颗粒的、来源于质粒、细胞或辅助病毒的杂质DNA。不同的杂质在免疫毒性中可能扮演特定的角色。因此,AAV产品的安全性、纯度和质量都应受到严格控制。下图是AAV产品纯度和安全性的当前检测的方法和规格(M.Penaud-Budloo, et al., 2018)。
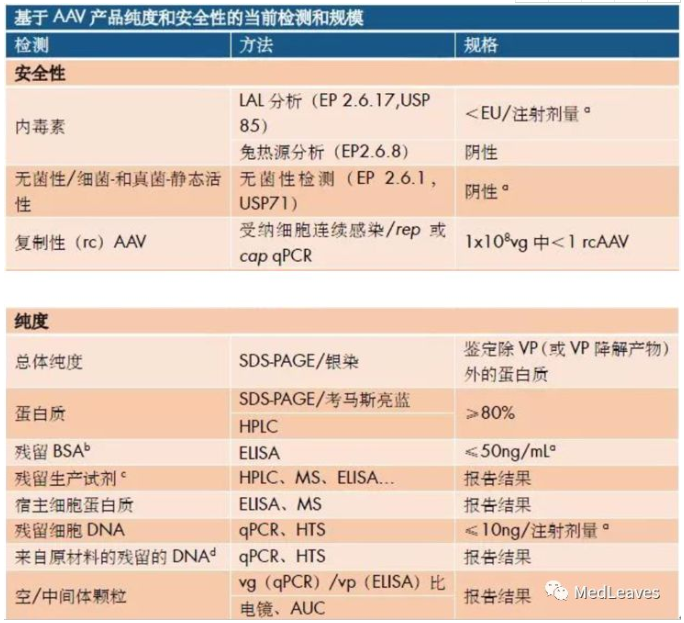
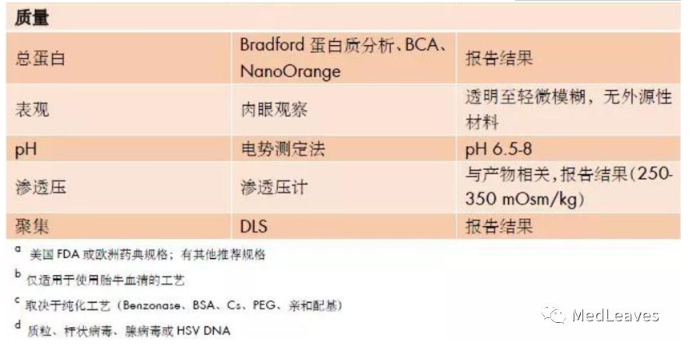
AAV储液中含有不小量的杂质,需在生产过程中尽可能地去除,并使用优化的分析方法,进行鉴定和定量。虽然目前还没有与这些杂质有关的负作用的报导,但之后对于系统性给予高剂量载体(>1x10^14vg/kg)的应用,需特别关注,因为杂质的总量会升高,且给药途径可能触发免疫毒理反应。
04
AAV基因疗法策略
病毒作为载体,可以引入新的DNA做基因表达(针对缺乏正确蛋白)、携带shRNA做基因沉默(减少靶蛋白表达)、ZFN或Cas的基因及配套元件做基因编辑。
4.1 基因表达
这一策略的目标是递送表达正常蛋白的基因来弥补功能丧失性突变的影响。它适用于治疗隐性单基因疾病,已经临床试验中获得极大成功。Glybera和Luxturna就是很好的例子。Glybera基于重组AAV1平台递送表达编码脂蛋白脂肪酶(LPL)的转基因,它用于治疗LPL缺失患者。而Luxturna则使用AAV2平台来递送正常RPE65基因。这两款疗法都使用局部注射的施药方法,分别注射到患者的肌肉和眼睛中。
新一代AAV血清型的发现让研究人员可以通过静脉注射AAV载体将转基因递送到全身。这些新的AAV载体为治疗A型和B型血友病(靶向肝脏),DMD(靶向全身肌肉)和SMA(广发靶向CNS,包括脊髓)带来了有效疗法。2019年获批的Zolgensma就是一个范例,这是一款利用AAV9载体递送编码运动神经元生存蛋白(SMN)的SMA转基因的基因疗法。在很多疾病中,只需在部分细胞中表达正常基因就足以缓解疾病的症状。
4.2 基因沉默
与基因替代相反,基因沉默的目标是治疗由于功能获得性基因突变导致的单基因疾病,例如亨廷顿病(Huntington disease)。RNAi疗法目前是AAV基因沉默平台的首选策略。然而,与合成RNAi疗法的飞速进展相比,基于AAV递送平台的RNAi疗法目前仍处于早期开发阶段。基因沉默需要在大部分组织中发生才能够起到有意义的治疗效果,在某些器官中(例如大脑),这对于AAV载体来说还是一个挑战。2019年1月,uniQure的基因治疗产品候选药物AMT-130 IND申请获得FDA的审批。该产品利用其专有的miQURE™沉默技术,由携带人工微RNA(micro-RNA, miRNA)的AAV5载体组成,治疗目标是抑制突变蛋白(mHTT)的产生,来治疗亨廷顿病。研究人员认为,使用AAV载体将微RNA直接递送到大脑中以非选择性地敲低亨廷顿蛋白基因,这代表了治疗亨廷顿氏病的高度创新和有前途的方法。
在RNAi策略以外,使用CRISPR-Cas系统来靶向RNA也是一种基因静默的策略。不过这一策略需要克服的障碍是重组AAV容纳的转基因大小有限,而且从细菌中发现的Cas蛋白可能引发免疫反应,从而降低疗效。
4.3 基因编辑
截至目前,基于基因疗法的临床试验及上市药物主要以外源基因增补的方式通过病毒递送来治疗疾病,但新兴的以核酸内切酶为基础的基因编辑技术(如ZFN、TALEN和CRISPR/Cas9)也正被科学家们开发用于疾病的治疗。具有极强组织靶向可塑性的AAV与可行使多种功能CRSIPR系统的结合,已成为一个功能强大且潜在用途广泛的动物实验工具。目前已发表以AAV为载体的CRISPR应用研究主要有基因敲除、基因片段删除、精确同源重组修复三类。2019年9月,密苏里大学医学院的研究人员在一项小鼠研究中表明,基于AAV9的CRISPR基因编辑技术,可以被用来有效地编辑肌肉干细胞(MuSCs),编辑的细胞中再生的细胞成功地产生了抗肌萎缩蛋白(dystrophin),这可能为终生纠正导致杜氏肌营养不良症(DMD)的基因突变提供了一种潜在的方法。而它的优势在于永久性的改变了DMD患者突变基因的结构,因此理论上只需要一次治疗,就可以让患者终生受益。
05
腺相关病毒载体主要应用
5.1 视网膜疾病基因疗法中的腺相关病毒载体
重组AAV递送的基因疗法的一个重要方向是CNS,包括眼睛和大脑。视网膜作为一个相对“免疫特赦”的器官被视为载体介导的基因治疗的理想位点,仅需较小的剂量就可达到最佳的效果。Spark Therapeutics公司开发的获批疗法Luxturna就是治疗由于RPE65基因突变而导致失明的患者。2,5,7-9型的AAV能够感染感光细胞,而几乎每种血清型的AAV都能感染视网膜色素上皮细胞,这两种细胞都参与了视网膜变性的病理过程。其中2型AAV作为基因疗法中的病毒载体研究较多,并得到了最为广泛的应用。2019年7月,Edita公司开展了针对先天性黑蒙症10-型的基因治疗的I / II期临床研究,这将有可能成为全球第一个获批上市的基于AAV介导治疗10-型莱伯氏先天性黑朦疾病的在体 CRISPR 基因编辑药物。
5.2 骨骼肌疾病基因疗法中的腺相关病毒载体
骨骼肌疾病的基因疗法中广泛使用的AAV载体,通常为AAV1,AAV2和AAV9型载体。2012年在欧洲获准用于治疗罕见的脂蛋白脂肪酶缺乏症的基因疗法Glybera,也是第一个获准上市使用的AAV基因疗法,其载体即以AAV1为基础。最近,经一系列基因工程改造而获得的杂交或突变衣壳被用于骨骼肌领域,其中包括AAV2. 5 (AAV2 +5个AAV1残基)、酪氨酸突变的AAV1 (Y445F/Y731F)以及AAV9.45 (AAV9+两个点突变)。这些经过改造的载体具有更好的骨骼肌亲嗜性、更低的免疫原性以及较低的降解率。目前,使用AAV载体的基因疗法有针对杜氏肌营养不良、贝氏肌营养不良、肢带型营养不良、运动障碍与庞贝病等疾病的临床试验。值得一提的是,肌肉可以作为生成治疗性分子的“体内工厂”,因此靶向肌肉组织的基因疗法可以用于治疗非肌肉疾病。
5.3 血液病基因疗法中的腺相关病毒载体
早期的血友病基因疗法中使用过多种载体,如非病毒、逆转录病毒、Ad等载体,尽管其安全性从未出现过问题,但却无法维持高水平的长期表达。目前普遍认为重组AAV载体是最适用于B型血友病的载体,通过向患者体内递送FIX对严重B型血友病的成功治疗被认为是基因治疗临床应用的里程碑。在正在进行的I / II期临床试验中,FVIII和FIX分别被递送给A型和B型血友病患者。另外针对粘多糖血症的治疗药物SB-318和SB-913的I / II期临床试验也正在进行中。
5.4 神经疾病中的腺相关病毒载体
腺相关病毒载体可用于治疗神经疾病的基因治疗平台,在临床前研究中,通过各种给药途径,编码治疗性蛋白质、微小RNA、抗体或基因编辑的转基因已经成功递送至中枢神经系统。目前的临床研究已证明AAV基因治疗在帕金森综合征和脊髓性肌萎缩等疾病中具有令人鼓舞的安全性和有效性以及转基因表达的持久性。一个成功案例是脊髓性肌萎缩的治疗,由运动神经元存活蛋白-1(SMN1)基因突变是引发该疾病的主要原因。2019年,美国美国FDA批准了由Novartis公司AveXis Inc.开发的基于AAV介导体内表达SMN1蛋白的药物Zolgensma,用于治疗SMN-1缺失的脊髓性肌萎缩症的婴儿患者。
06

基因疗法市场预测
6.1 已获批和临床阶段AAV载体基因治疗药物
截至目前,在ClinicalTrials.gov上有二百余项临床试验中使用重组AAV载体来治疗多种疾病,占所有基因治疗临床研究的8.1%。包括A/B型血友病、先天性黑蒙症、遗传性脉络膜视网膜营养不良、全色盲和Leber的遗传性视神经病变(LHON)。此外,还有许多临床试验正在测试用AAV来治疗溶酶体贮积症、阿尔茨海默病、帕金森病、肌萎缩侧索硬化症(ALS)、癫痫、1型脊髓性肌萎缩、异染性脑白质营养不良、芳香族L-氨基酸脱羧酶缺乏症(AADC),以及巴特病等。
目前,已有三款重组AAV载体已经获得批准在患者身上使用,它们是uniQure公司开发的Glybera(AAV1),Spark Therapeutics公司开发的Luxturna(AAV2)和诺华公司开发的Zolgensma(AAV9)。
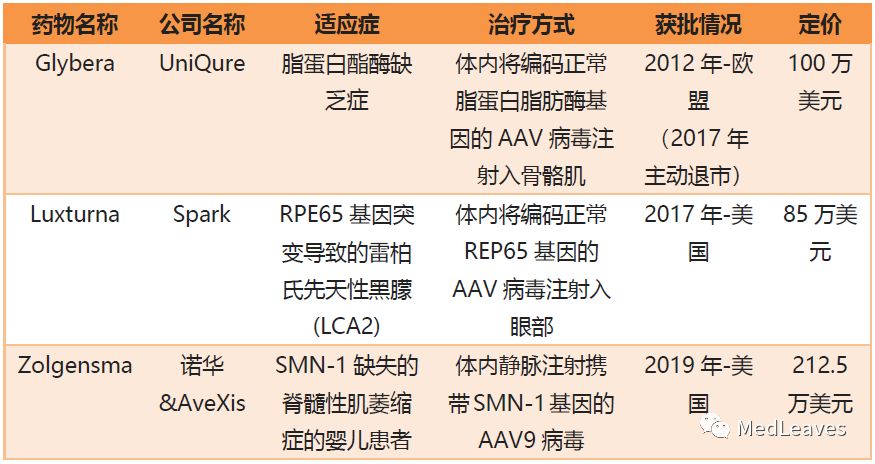
表 已上市的三款rAAV载体基因治疗药物
EvaluatePharma于2019年初发布报告,预计在未来六年内,将有大约60种基因疗法产品获批。这些药物的销售额在2024年将达到146亿美元,约占全球医药总收入的1.2%。据统计,2018年全球共有20家基因治疗企业获得融资,融资总额17亿美元。2019年上半年,基因治疗领域共有13家医药企业获得融资,融资总额12亿美元。
6.2 国际制药巨头争相布局基因治疗领域
从2018年开始,基因疗法领域持续升温,种种迹象表明,基因疗法领域正在迎来一个激动人心的时代。近几年,基因治疗领域并购案例不断,大型制药企业收购在研发管线上拥有较强竞争力的创新公司,基因治疗领域在小型初创公司不断激增的同时,也逐渐向着稳定的市场格局发展。从被收购标的来看,AAV载体更受到收购方的青睐。
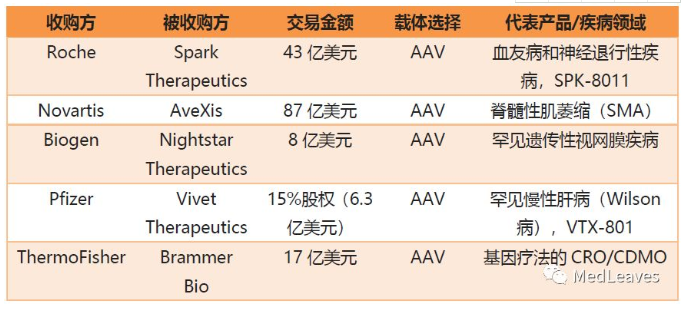
表 基因治疗领域并购案例
6.2.1 诺华
2018年4月,诺华以87亿美元现金收购美国基因治疗公司AveXis。AveXis使用AAV9载体开发和商业化基因治疗,治疗脊髓性肌肉萎缩症(SMA)的新药AVXS-101获FDA突破疗法指定,成为首款一次性治疗SMA的基因治疗用药。另外,两种罕见的神经系统单基因疾病:Rett综合征(RTT)和肌萎缩侧索硬化症(ALS)正处于临床前开发阶段。
6.2.2 罗氏
2019年2月,罗氏以43亿美元的金额收购基因疗法明星公司之一Spark Therapeutics。Spark是基因治疗的先锋企业,代表药物:Luxturna是首次用AAV腺相关病毒的基因疗法,用于治疗基因缺陷引起的视网膜病变(IRDs)的患者。此疗法用AAV将健康的RPE65基因引入患者体内,让患者生成正常功能的蛋白来改善视力。它不但能治疗先天性黑蒙朦症,还能够治疗其他由RPE65基因突变引起的眼疾。在Spark公司的在研管道中,还有包括遗传性视网膜疾病(IRDs)、肝脏介导疾病、血友病、溶酶体贮积症、亨廷顿舞蹈症等疾病的研究。研发管线中的每个研究项目都是Spark团队及其合作者开发和制造的腺相关病毒(AAV)作为载体。
6.2.3 百健
Nightstar Therapeutics创立于2013年,总部位于英国,是一家基因治疗方法研发商,专注于用AAV治疗遗传性视网膜疾病研究,于2018年在纳斯达克上市。2019年,其全部股份被百健Biogen以8.77亿美元收购。目前公司推出了两款治疗视网膜疾病的基因疗法:主要产品 NSR-REP1正处于Ⅲ期临床阶段,针对无脉络膜症(一种罕见的视网膜疾病,目前尚无医治手段),另一款NSR-RPGR针对色素性视网膜炎(XLRP)正处于1/2期临床试验阶段。
6.2.4 辉瑞
2019年3月,辉瑞斥资6.36亿美元收购法国Vivet Therapeutics公司15%的股份,共同开发一款基于新型改造的AAV载体,针对威尔逊病(WD)的基因疗法VTX-801V。
6.2.5 赛默飞世尔
2019年3月,赛默飞世尔以17亿美元收购Brammer Bio。Brammer Bio 是为开发基因疗法和基因修饰细胞疗法的制药公司提供外包研究和制药服务。
6.3 国内企业布局基因药物治疗领域情况
国内AAV制备CRO、CMO体量小,随着研发热潮来临,增量空间巨大,典型企业有宜明细胞、和元生物、派真、枢密、五加和等。
6.3.1 宜明细胞
宜明细胞致力于细胞和基因治疗技术的开发和应用,能够为基因治疗研发、临床、产业化提供整体解决方案,业务涵盖细胞及基因治疗创新药CRO、CDMO服务。专家团队来自哈佛大学、霍普金斯大学、马里兰大学、加拿大哥伦比亚大学(UBC)等国际知名院校的院士或研究员,在细胞治疗及基因治疗领域拥有十余年的产业经验。宜明细胞拥有独特的C+A厂房设计,绝对A级隔离的生产方式,独立完整的GMP体系,充分保证了生产在合规的条件下进行,同时通过组建专业的质量管理团队、生产团队、药品注册团队,经过多个的GMP产品的磨合,大幅度降低了生产成本。
在对临床级AAV产品的生产工艺和过程的充分理解基础之上,宜明细胞在GMP体系下开发出一套适应于规模化生产的上游发酵平台以及下游分离纯化工艺,工艺经过验证并保持稳定,以确保临床级产品质量、安全性和一致性。

图 GMP AAV生产流程
6.3.2 和元生物
和元生物是一家集基础研究服务、基因治疗药物研发和临床级重组病毒产业化制备三大发展方向于一体的高新技术企业。和元拥有基因治疗载体研发中心、SPF级动物实验室、中试工艺开发与生产实验室,以及基于一次性技术的GMP级重组病毒车间,并依托先进的重组病毒产业化生产、病毒载体修饰改造与包装,CRISPR/Cas9基因编辑、脑立体定位注射及成瘤模型构建等多种技术,为基因治疗行业的崛起提供有力平台。
2019年3月5日,和元与GE医疗联手打造的基于一次性技术的病毒载体CDMO生产平台在上海张江正式开业运行,该平台是国内首个基于一次性技术的GMP病毒生产平台,能够为基因治疗或细胞治疗相关药物研发提供GMP大规模生产一站式服务。
6.3.3 五加和
五加和是专业从事基因治疗药物核心技术研发和服务的生物高科技公司,其基因治疗CDMO平台服务范围包括科研服务、符合GMP要求的中试和临床级制品的制备、质量研究服务,满足客户从早期研发、新药临床试验申报和I/II期临床试验的要求。涉及的载体种类包括腺相关病毒载体(AAV)、腺病毒载体(AdV)、单纯疱疹病毒载体(HSV)、慢病毒载体(LV)和质粒DNA;全方位为基因治疗领域客户提供从工艺开发、小试、中试到临床样品生产的一体化CDMO解决方案,加速基因治疗或细胞治疗药物上市。
6.3.4 派真生物
派真生物(美国PackGene Biotech,总部位于美国马萨诸塞州),专注于快速、大规模生产高纯度、高滴度、高感染力的临床前和临床级别重组腺相关病毒。派真生物创始人李华鹏博士(美国麻省大学医学院基因治疗中心博士后)与科学家顾问团队专注于AAV载体的创新与生产,在AAV生产方面获得多项发明ZL。自2014年12月创立以来,已为6个国家的学术及工业机构定制生产超过1000个AAV,其中为美国两大生物医药公司提供超过600个定制AAV。
6.3.5 枢密
枢密,成立于2014年底,公司致力于开发以病毒载体为核心技术的基础科学研究工具和临床医学转化产品,并为基础科研和临床转化提供整体解决方案,是中科院生物技术转化平台。目前服务国内50多个顶级实验室和医院,为国家重点实验室技术支撑单位。公司开发了包括腺相关病毒、慢病毒、狂犬病毒、伪狂犬病毒、单纯疱疹病毒、疱疹性口炎病毒在内六大病毒体系,拥有完整的生物学实验平台,包括分子克隆、细胞、纯化与检测、动物实验与生理学、行为学、光学与磁共振分析平台。
目前,公司还开发了在适合高效生产重组腺相关病毒(rAAV)的新型杆状病毒系统。新型系统灵活性高、通用性强、病毒质量高、产量高,有效解决了rAAV大规模制备较难的问题,同时大大降低基因治疗药物研发的成本。
结语
基因疗法是获得业界关注的创新治疗平台。而作为递送转基因的有力手段,AAV载体平台的研发也在出现指数型增长。AAV载体有非常显著的优势,如安全性、长效性、多种血清型等,这都使AAV载体在基因治疗中迅速崛起。目前已经有三款AAV载体基因药物上市,还有二百余种处于临床试验阶段的药物。越来越多的大制药公司,如诺华、百健、罗氏、辉瑞等在正在通过并购等方式深入扩大或引入自身在基因治疗的业务板块,通过掌握核心技术及生产能力保证在这一赛道的竞争力。国内起步较晚,相关公司数量较少,处于早期阶段;随着研发热潮来临,将会有巨大增量空间。
但AAV载体平台的发展仍然需要克服多项挑战,最重要的是如何经济有效地生成足够数量的治疗性AAV载体,以及克服人体免疫系统对AAV载体和转基因产物的免疫排斥作用。克服这些挑战对推广AAV介导的基因疗法具有关键性的意义。