内含子 (intron) 是基因中非编码的区域。在转录过程中,DNA上的内含子会被保留在pre-mRNA中。因此在mRNA离开细胞核被翻译之前,内含子会被剪除,而编码蛋白质的区域外显子 (exon) 会被拼接起来。这个过程称为pre-mRNA剪接。pre-mRNA剪接是由一个被称为剪接体 (spliceosome) 的高度复杂的巨大核糖核蛋白 (RNP) 复合体负责。剪接体由5个核内小分子核糖核蛋白 (snRNP): U1 snRNP, U2 snRNP, U4/U6.U5 tri-snRNP和其他非snRNP蛋白质组成。剪接体通过识别内含子上的5端剪接位点 (5’ splice site, 5’SS)、3端剪接位点 (3’ splice site, 3’SS) 以及分枝位点 (branch site,BS) 来确保正确的剪接【1】。
剪接位点识别主要是在早期剪接体组装过程中完成的。简单地说,在早期剪接体组装过程中,U1 snRNP通过其U1 snRNA与5端剪接位点进行碱基配对,形成U1-5’SS RNA双螺旋,从而完成5端剪接位点选择,并形成最早的剪接体E complex。随后,U2 snRNP通过其U2 snRNA与分支位点序列 (BS) 进行碱基配对,形成U2-BS RNA双螺旋,从而完成分支位点的选择,形成剪接体A complex。先前,作者团队解析了人类U2 snRNP的三维结构,并揭示了U2 snRNP中的Prp5蛋白如何通过依赖ATP的途径对U2 snRNP构象进行改变,从而触发U2 snRNA识别内含子分支位点序列,并形成A complex (详见BioArt报道:Nature | 张祯威等解析人类17S U2 snRNP三维结构)。在形成A complex之前/过程中,Prp5还会对分支位点序列进行校对(图1)【2,3】。由于错误的位点识别将导致错误的mRNA,最终导致错误的蛋白质产生以及多种疾病的发生。因此,剪接体在工作的过程中,会在多个步骤进行校对【4】。然而,剪接体实现其保真性的具体分子机制在很大程度上仍然是未知的。因此,解密Prp5在早期剪接体中校对分支位点序列的分子机制可以更好地了解剪接体如何确保其保真性。

图1: 早期剪接体的组装过程
2021年8月4日,德国马克思普朗克生物物理化学研究所 (MPIbpc) 的Holger Stark组, Reinhard Lührmann组在Nature合作发表题为Structural insights into how Prp5 proofreads the pre-mRNA branch site的研究文章。来自Holger Stark组的张祯威为本文的第一作者。该研究首次发现了Prp5并不直接校对分支位点的RNA序列,而是通过感知核糖核蛋白 (RNP) 的整体构象,从而间接校对分支位点序列。
在这项研究中,作者通过删除pre-mRNA的分支位点腺苷 (Branch site adenosine, BS-A) 或在分支位点引入突变,将酵母 (S. cerevisiae) 的剪接体抑制在E complex和A complex的中间状态。作者通过冷冻电子显微镜 (cryo-EM) 技术对这个中间状态进行结构解析,并将这个全新的状态命名为pre-A complex。在蛋白质交联质谱数据的指引下,作者构建了pre-A complex 的分子模型 (图2)。
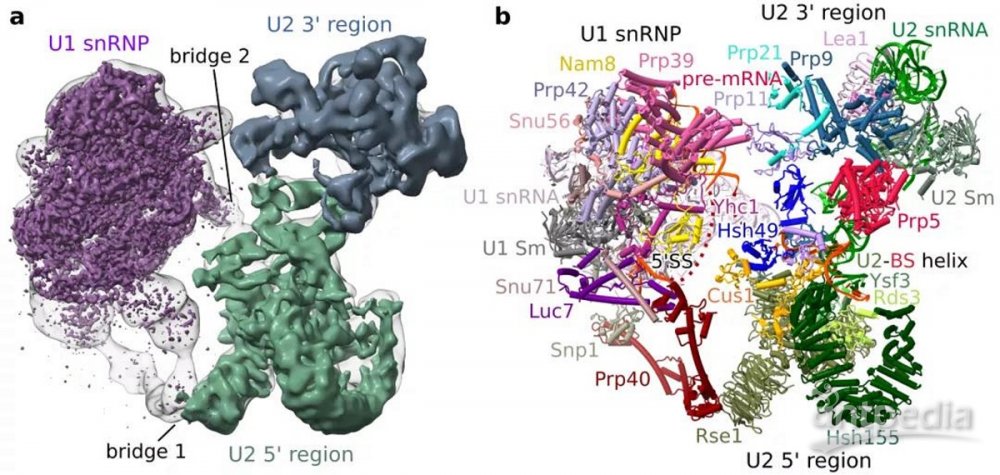
图2: pre-A complex的三维结构
在pre-A complex中,作者发现U2 snRNA虽然已经与分支位点序列 (BS) 进行碱基配对,并形成了U2-BS RNA双螺旋,然而由于BS-A的缺失,U2 snRNP的Hsh155蛋白仍保持开放状态,等待与U2-BS RNA双螺旋的结合。因此,作者推定,BS-A插入Hsh155蛋白口袋是触发Hsh155闭合的直接原因。此外,通过对比pre-A complex与先前发表的A complex,作者发现在pre-A 到A complex转变的过程中,U1和U2 snRNP发生了巨大的构象变化,且这个构象变化是剪接体进行下一步pre-B complex组装所必须的。作者进一步发现Prp5的结合阻断了这个构象变化,从而抑制了剪接体下一步的组装 (图3)。相反的,当Hsh155呈闭合状态并与U2-BS RNA双螺旋紧密结合后,便会触发Prp5的离去,从而允许剪接体的下一步组装。综上,Prp5并不直接校对分支位点RNA序列的正确性,而是感知U2-BS RNA双螺旋是否与Hsh155正确结合,以及Hsh155是否正确闭合。即Prp5校对核糖核蛋白的整体构象。
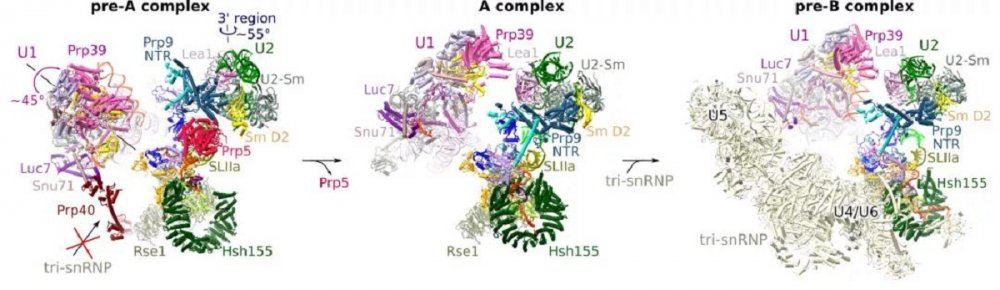
图3:Prp5阻断剪接体的进一步组装
最后,结合本次研究以及先前发表的生化以及结构学研究,作者提出了早期剪接体组装以及Prp5间接校对分支位点序列的模型。首先,在U2 snRNP与E complex结合后,Prp5 利用ATP的能量,对U2 snRNP重构,并触发U2-BS RNA双螺旋的形成。在正常状态下,U2-BS RNA双螺旋上的BS-A插入Hsh155,并引发后者闭合。U2-BS RNA双螺旋与Hsh155的结合以及Hsh155的闭合共同导致Prp5的离去。Prp5的离去为剪接体的进一步组装亮起“绿灯” (视频1)。相反的,若分支位点序列有误,BS-A将不能正确插入Hsh155并与之结合,从而导致Prp5的滞留。Prp5的滞留阻断了剪接体进一步的组装,从而避免剪接体利用有缺陷的分支位点序列 (图4)。Prp5是DEAD/H-box RNA解旋酶 (helicase) 家族的一员。DEAD/H-box RNA解旋酶家族在剪接过程中对多个步骤进行校对【4】。Prp5间接校对的模型为剪接体保真性分子机制提出了全新的思路。
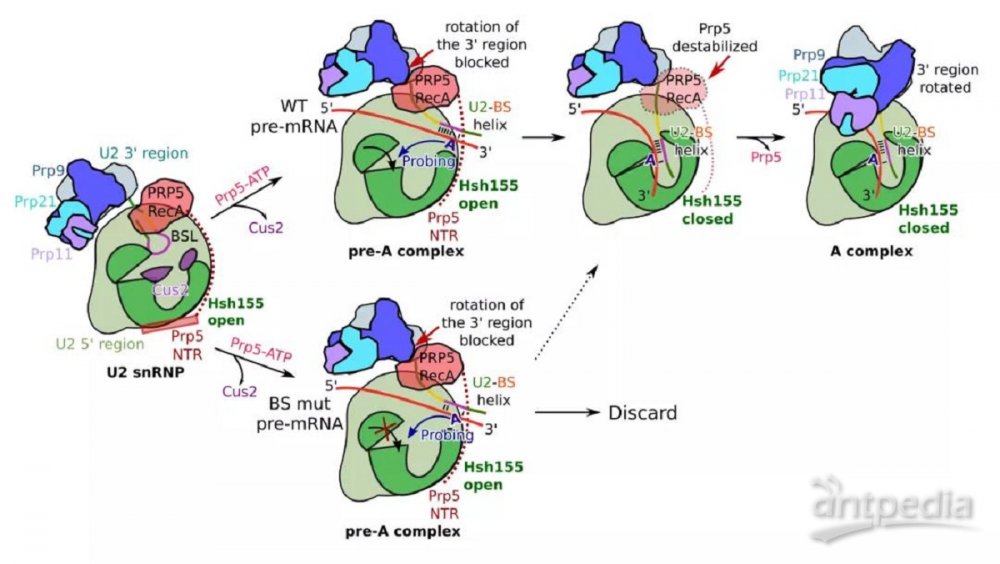
图4:Prp5校对分支位点序列的模型