复发难治急性髓系白血病(refractory/recur-rentacutemyeloidleukemia,R/RAML)对普通化疗药物不敏感,甚至耐药,尤其是老年R/RAML,再次使用强化疗缓解率<30%[1],可能通过异基因造血干细胞移植治愈,但治疗相关死亡率及复发率均高。随着基因测序技术及分子机制研究的进步,一些低毒新药的出现给R/RAML的治疗带来了创新和曙光。下面介绍3例BCL2抑制剂Veneto-clax联合化疗在R/RAML中的应用。
1病例资料
病例1,患者女,52岁,2016年9月21日诊断急性淋巴细胞白血病,初诊血常规:WBC20.5×109/L,Hb80g/L,PLT24×109/L;骨髓形态:急性淋巴细胞白血病可能性大,原幼细胞94.0%;白血病免疫分型提示:77.0%幼稚细胞,B淋系表达;染色体:细胞少,未见分裂相;BCR/ABLFISH阴性;多重PCR阴性;基因突变阴性。9月23日起给予CIVP方案化疗(环磷酰胺1.2gqd×1d,伊达比星10mgqd×3dd1~3,长春地辛4mgqw×1次,地塞米松15mgqd逐渐减量),化疗第14天复查骨穿回报:原幼63%。10月12日起给予AAG方案化疗(阿糖胞苷10mg/m2q12h×14d+阿克拉霉素20mgqod×5次+粒细胞集落刺激因子(G-CSF)300μgqd依据每日白细胞计数调整用量,化疗第7天给予培门冬酶3750U治疗;10月28日复查骨穿:骨髓增生极度低下,原幼1%。11月18日给予大剂量甲氨蝶呤+培门冬酶方案巩固化疗。2016年12月16日起行中剂量阿糖胞苷1g/m2q12h×3d方案巩固化疗,2017年1月9日起给予改良BuCy方案预处理,1月19日至20日回输儿子(男供女、血型A+供AB+,HLA配型5/10相合)造血干细胞,共回输单个核细胞12.7×108/kg,CD34+细胞绝对值3.5×106/kg,CD3+细胞绝对值1.66×108/kg。患者+12天粒系造血重建。2018年8月16日复查骨穿示原幼细胞比例升高,占11%,白血病免疫分型:7.6%的幼稚细胞群体,为髓系表达,多重PCR:NUP98-HOXA9(+),染色体46,XY[20],二代测序提示IDH1(+),STR(供体嵌合率)98%,性别FISH:分析1000个细胞均为XY男性杂交信号,考虑供体来源AML,后予以干扰素联合供体淋巴细胞输注治疗。2018年11月22日复查骨髓提示原幼35.5%,STR98.5%,予以阿扎胞苷75mg/m2×7d联合来那度胺25mg×10d治疗。2018年12月10日复查骨髓示AML未缓解,原始细胞28.8%。2018年12月13日给予AAG方案化疗(阿糖胞苷10mg/m2q12h×14d+阿克拉霉素20mgqod×5次+G-CSF300μgqd依据每日白细胞计数调整用量),12月29日复查骨髓提示AML未缓解,原始细胞40.5%。2019年1月7日给予阿糖胞苷20mg/(m2·d)×14d联合Venetoclax200mg/d爬坡至300mg/d(d1~16),Venetoclax使用28d,2019年1月30日复查骨穿提示缓解,未见原幼细胞,NUP98-HOXA9:未检测到融合基因转录本,IDH1突变转阴。2019年2月15日开始第2个疗程巩固治疗,阿糖胞苷20mg/(m2·d)×14d联合Vene-toclax400mgqd×21d,疾病至今缓解中。
病例2,患者男,64岁,2017年10月因乏力盗汗至当地查血常规示:WBC84.6×109/L,Hb134g/L,PLT157×109/L,10月13日骨髓形态示骨髓增殖性疾病,染色体示:47,XY,?+21/?22q-[2]/46,XY[18],白血病免疫分型提示0.8%的幼稚细胞群体,为髓系表达,BCR/ABL阴性,MPN组套示JAK2exon4(+),B超提示脾脏肿大(最大长径164mm),诊断MPN,予以羟基脲降白治疗。2017年11月30日复查血常规示:WBC37.38×109/L,Hb131g/L,PLT74×109/L,二代测序示TET2、EZH2、JAK2基因V617F、CBL基因突变阳性。患者自行调整羟基脲剂量降白治疗。2018年12月11日复查血常规示:WBC69.23×109/L,Hb113g/L,PLT29×109/L,外周血涂片见原始+幼稚细胞比例26%。骨髓形态示全片原幼细胞56%,急性白血病(M4可能,ALL待排)。白血病免疫分型提示髓系单核系表达。多重PCR均阴性。染色体:50,XY,+8,+11,+13,+19[1]/46,XY[4]。二代测序:JAK2、ASXL1、EZH2、CBL、TP53突变阳性。骨髓活检提示急性白血病伴纤维组织增生(Ⅲ级)。诊断:骨髓增殖性肿瘤急变期
(MPN-BP),AML。2018年12月15日给予地西他滨20mg/m2×5d联合IAG[阿糖胞苷20mg/(m2·d)×10d,伊达比星5mg×6d,G-CSF300μgqd,根据血常规调整]方案化疗,12月29日粒缺期复查骨穿,骨髓提示原幼细胞比例较前明显降低,骨髓像未缓解且骨髓重度抑制,全片原幼细胞占27%。2019年1月28日血常规恢复后再次
行骨穿,骨髓形态示全片原幼细胞43%,染色体:50,XY,+8,+11,+13,+19[6]/46,XY[4],考虑疾病未缓解,2月2日给予地西他滨20mg/m2×5d联合Venetoclax200mg/d爬坡至400mg/d,治疗期间Hb升至80g/L,PLT回升至90×109/L,3月4日复查骨提示骨髓增生极度低下,原幼细胞占55%。3月12日起阿扎胞苷75mg/m2×7d化疗,期间Venetoclax持续使用,因后续行异基因造血干细胞移植且考虑粒缺时间长,于4月1日停止口服Venetoclax。4月12日复查骨穿提示有核细胞增生低下,原幼细胞17%。
病例3,患者女,72岁,2018年1月因腹部皮肤散在瘀点就诊当地医院,血常规:WBC15.13×109/L,Hb99g/L,PLT41×109/L,原始细胞55%。遂入院完善检查:2018年1月25日骨髓形态示:AML(M5或M2待排),原幼细胞79%;流式细胞术提示髓系表达,染色体:46,XX[20],免疫分型示:分析89%的幼稚细胞群体:CD13,CD33,CD177阳性,余阴性,为髓系表达;多重PCR阴性;二代测序:检测到IDH1基因R132S突变(49.1%),FLT3基因ITD突变(43.2%),NPM1基因A型突变(60%),NOTCH1R1586H突变(56.5%)。2018年1月26日行地西他滨(20mg/m2×5d)+AAG(阿糖胞苷0.02g×7d,阿柔比星20mg×8d,G-CSF随血常规调整)方案化疗,2018年2月6日骨髓形态示:原幼细胞比例仍增高32%。3月21日骨髓形态提示:骨髓缓解;MRD1.9×10-3;基因突变示:FLT3-ITD、IDH1R132S、NPM1exon12阴性,NOTCH1R1586H阳性。2018年3月23日,5月19日,7月26日给予去甲基化联合预激治疗后行微移植治疗3次,具体为地西他滨d1~8(20mg/m2×8d)化疗,3月31日给予半程IAG(伊达比星5mgd1、d3、d5,阿糖胞苷15mgd1~7,G-CSF依血常规调整),治疗期间骨髓均处于缓解状态,基因突变:FLT3-ITD、IDH1R132S、NPM1exon12均阴性,NOTCH1R1586H阳性。2019年4月27日患者血小板下降,查血常规提示:WBC3.97×109/L,Hb99g/L,PLT37×109/L,外周血细胞分类:原幼细胞72%,考虑白血病复发,现为进一步巩固治疗入院。2019年4月29日骨髓形态学:骨髓增生低下,原幼细胞占23%,考虑本病复发,患者入院后于4月24日起给予地西他滨去甲基化治疗联合Venetoclax口服,具体为地西他滨20mg/m2×5d,Venetoclax200mg逐步加量至400mg,5月16日停用。2019年5月9日骨髓形态学:骨髓抑制。2019年5月8日MRD示:1.1%,5月20日血常规示:WBC5.3×109/L,Hb88g/L,PLT160×109/L,同时复查骨穿,穿形态示:骨髓完全缓解,MRD:2.3×10-4。
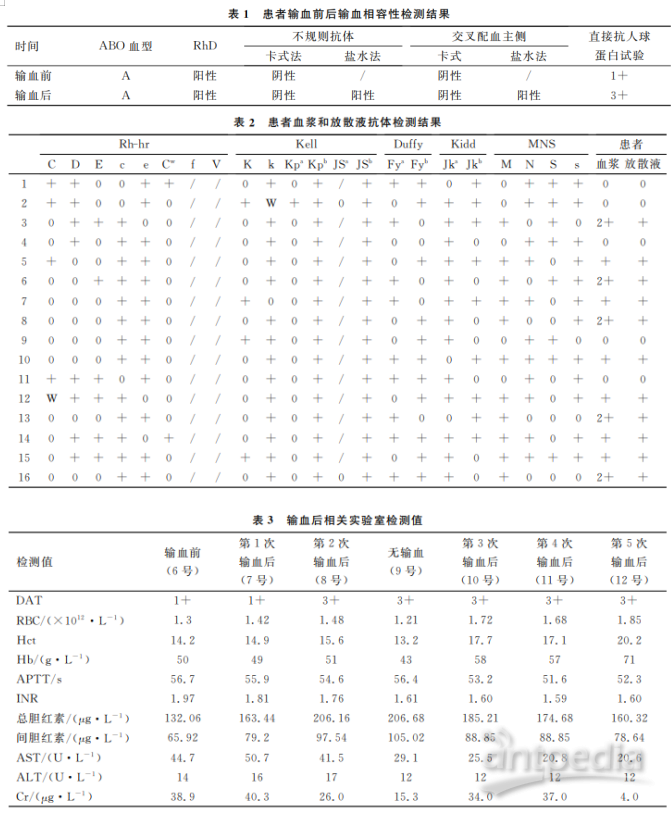
2讨论
BCL2家族蛋白在细胞死亡调控中起重要作用,它是1985年被发现的第一个抗凋亡基因[2]。一些研究表明BCL2高表达的AML对化疗药物耐药且总体生存时间短[3-4]。Venetoclax是BH3类似物,选择性地抑制BCL-2,在AML细胞系和原代细胞及动物实验中均证实Venetoclax有杀伤AML细胞作用[5]。在临床试验中,Venetoclax单药在R/RAML中应用的CR率为19%[6]。在145例初治老年AML中,Venetoclax联合去甲基化治疗(阿扎胞苷BCL2抑制剂Venetoclax联合化疗在3例复发难治急性髓系白血病中的应用及文献复习第7期或地西他滨)CR+CRi率达67%。其中标危及高危组CR+CRi率分别为74%和60%,伴有IDH1/2突变的CR+CRi为82%,伴有NPM1突变的CR+CRi率为91.5%[7]。Wei等[8]在71例老年AML中使用Venetoclax(600mg)联合小剂量阿糖胞苷(20mg/m2qdd1~10)持续反应率为64%,其中高危组中位生存时间为11.4个月。本文中均为难治复发AML,病例1是异基因造血干细胞移植后供体来源的AML,对多种治疗无效,但使用Venetoclax1个疗程后疾病达分子学缓解,IDH1基因突变及融合基因NUP98-HOXA9均转阴。Kontro等[9]通过体外实验证实BCL2抑制剂对伴有参与染色质修饰相关基因如WT1、IDH1/2基因突变的AML细胞比较敏感,对伴有HOXA及HOXB基因转录本过表达的细胞非常敏感。IDH1和IDH2突变使2-羟戊酸(2-HG)介导抑制线粒体电子传递链细胞色素c氧化酶(COX)活性,使线粒体的阈值降低,从而使原始细胞对BCL2抑制剂敏感。病例3老年AML不能耐受高强度化疗,同时伴有IDH1、FLT3-ITD、NPM1、NOTCH1突变,使用地西他滨联合Venetoclax2周即达到形态学缓解,较初次使用地西他滨联合预激治疗效果明显,可见Venetoclax对敏感肿瘤细胞的杀伤速度非常快。Pollyea等[10]证实Venetoclax联合阿扎胞苷在24h内可清除外周血中大部分原始细胞,6d可以完全清除肿瘤细胞。结合病例3考虑Veneto-clax在疾病缓解中起决定性作用,且起效迅速,由于这个特点,肿瘤负荷重的患者早期使用Veneto-clax需警惕肿瘤溶解综合征的发生。病例2是伴有TP53突变的继发AML(MPN转化),对普通化疗药物耐药,中位生存时间2个月,患者使用Venetoclax耐受性良好,2个疗程虽然未缓解,但降低肿瘤负荷,为桥接移植创造了时间和机会(白细胞下降,肿瘤符合降低)。DiNardo等[7]报道Venetoclax联合去甲基化治疗伴有TP53突变的老年AML患者CR+CRi率可达47%,中位生存时间为7.2个月。体外实验证明联合使用Veneto-clax及芦可替尼,Idasanutlin,Cobimetinib,Se-linexor可降低肿瘤细胞对前者的耐药性[11-14],提高对肿瘤细胞的杀伤性,是否对伴有TP53基因突变患者有益,仍需更多的实验数据积累。Venetoclax在使用过程中的主要不良反应为恶心、粒细胞缺乏、血小板低下,但通常都能耐受,它在R/RAML中的有效率仍需更多临床数据积累,是否能在初治AML中应用需要进一步的临床试验。
参考文献略。