神经系统肿瘤分类(WHO-2016)将脑膜孤立性纤维性肿瘤(solitary fibrous tumor,SFT)及血管外皮细胞瘤(hemangiopericytomas,HPC)重新界定为一类疾病,为来源于脑膜间叶组织的颅内脑外肿瘤,属于纤维母细胞/肌纤维母细胞来源肿瘤的中间性肿瘤,罕见。该肿瘤在中枢神经系统原发性肿瘤中<1%,多为良性,恶性及间变性极为罕见。现报道收治的1例脑间变SFT,并复习相关文献,讨论该肿瘤的临床病理特征、影像特征、诊断、治疗和预后。
1.病例资料
患者,男,67岁,因“头痛伴左侧肢体无力4天”于2017-09-28入院,无头晕、呕吐、视物模糊、肢体麻木、抽搐、大小便失禁。查体:神志清,计算力、定向力、理解判断力正常,记忆力轻度减退,左侧肢体肌力Ⅳ级,右侧肢体肌力Ⅴ级,肌张力正常,病理征阴性。当地医院头部CT提示:右侧顶叶脑出血。MRI示:右侧额叶混杂信号占位伴出血,考虑肿瘤性病变伴瘤卒中可能(图1)。
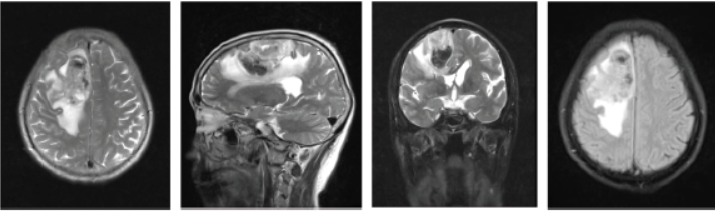
图1头颅MRI:右侧额顶叶片状混杂信号影,以等T2为主,其内伴点片状长T2信号,周围见片状水肿影,考虑肿瘤性病变合并出血
入院后复查头颅增强CT(图2):右侧额顶叶病变,考虑肿瘤性病变合并出血。初步诊断:“右侧额顶叶出血:瘤卒中?”。2017-10-01在我院神经外科行“右侧额顶叶窦镰旁占位性病变切除术及颅内减压术”。
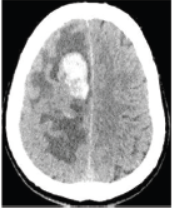
图2头颅CT:右侧额顶叶病变,考虑肿瘤性病变合并出血
术中见:颅内压高,右侧额顶叶可见约6 cm×5 cm×4 cm占位性病变,病变质地坚韧,血供较丰富。内侧与矢状窦及大脑镰相连紧密,难以分离,其他方向边界清楚,周围可见少许胶质增生带,血肿位于肿瘤前外侧方额颞叶深部脑实质内,量约20ml,周围脑组织水肿明显。
术后2天(2017-10-03,图3)头颅CT示右侧额顶叶可见大片状低密度影,右侧额顶叶病灶内可见斑片状稍高密度影及气体密度影混杂。术后我院病理检查报告为(脑)小细胞肿瘤;免疫组化:LCA(-)、NF(-)、GFAP(-)、S-100(-)、CD99(弥漫+)、FLAP(-)、EMA(-)、Vimentin(+)、Ki-67(+,20%)、CD34(-)、Bcl-2(+)、TLE-1(+)、STAT-6(-)、CK(-)、PR(-)、FLl-1(+),结果支持(脑)骨外尤文肉瘤/原始神经外胚叶肿瘤(ES/PNET)(图4)。
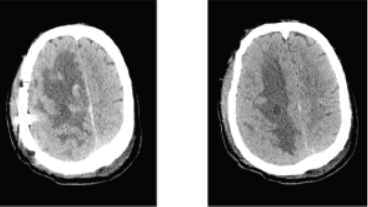
图3术后2天:右侧额骨、顶骨骨皮质不连续,呈术后改变。右侧额顶叶可见大片状低密度影,右侧额顶叶病灶内可见斑片状稍高密度影及气体密度影混杂
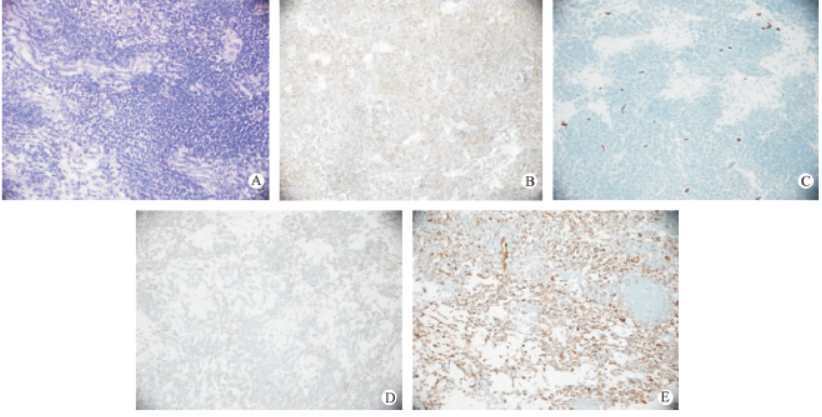
图4病理活检:(脑)骨外尤文肉瘤/原始神经外胚叶肿瘤(ES/PNET)A:SFT/HPC组织形态学表现(HE×200):肿瘤组织富于细胞,细胞多呈圆形或短梭形,细胞核深染,核分裂象多见。免疫组化染色(×200):B:肿瘤细胞胞质CD99(弥漫+);C:肿瘤细胞CD34(-);D:肿瘤细胞胞质bcl-2(+);E:肿瘤细胞胞质vimentin(+)。
为进一步确诊,于四川大学华西医院病理会诊。免疫组化结果:STAT-6(+)、CD99(部分+)、SMA(+)、CD34(-)、EMA(-)、SATB2(-)、BCOR2(弱+)、WT-1(部分+)、Ki-67(MIB-1)阳性率15%。FISH检测结果示:未检出EWSR1基因和SS18基因易位。结合免疫组化及基因检测结果诊断为间变型孤立性纤维性肿瘤/血管外皮细胞瘤(WHO3级)。术后3周(2017-10-30)给予辅助放疗,针对术后瘤床及周边亚临床病变区域行术后放疗(GTV60Gy/25f,CTV55Gy/25f)。放疗后1月复查显示状态良好,肌力及肌张力正常。
头颅MRI(图5)示右侧额顶叶异常结节明显缩小,右侧额顶叶水肿明显好转。目前患者随访中,恢复好。
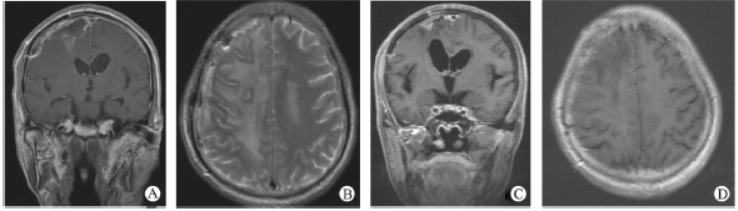
图5术后1月及放疗后1月头颅增强MRIA、B:术后1月,右侧额顶叶异常结节及术区脑膜明显强化,右侧额顶叶可见大片水肿带。C、D:放疗后1月,右侧额顶叶异常结节明显缩小,右侧额顶叶水肿明显好转。
2.讨论
孤立性纤维性肿瘤/血管外皮细胞瘤(SFT/HPC)是2016年WHO中枢神经系统肿瘤分类中新引入的一个联合诊断条目,此类肿瘤多在12q13位点发生NAB2和STAT6基因融合,导致免疫组化检测到的STAT6基因在核内表达。病理方面,SFT/HPC是一种纤维母细胞源性的间叶组织肿瘤,中枢系统少见。
光镜下,SFT/HPC主要有两种表型:一种为典型的孤立性纤维性肿瘤表型,即肿瘤细胞呈梭形,密度不均匀,形成疏松区和密集区,疏松区见大量嗜伊红染的胶原纤维束,分隔细胞杂乱排列的密集区,肿瘤内可见丰富的薄壁血管扩张;另一种为典型的血管外皮细胞瘤表型,肿瘤细胞密度较高,大小相对一致,无特定排列方式,胞质少,而间质血管丰富,血管壁薄。部分血管有不规则分支,呈经典的“鹿角状”。肿瘤可表现为以上任一形态或混合型。
根据2016年WHO中枢神经系统的分类,SFT/HPC可分为3级:Ⅰ级为经典SFT表型,细胞密度相对较低,有更多的胶原含量;Ⅱ级为经典HPC表型或与SFT表型混合存在,细胞密度较高,胶原减少;Ⅲ级为每10个高倍镜下至少有5个核分裂象,间变性HPC或恶性SFT或二者混合存在。
STAT6对诊断SFT/HPC具有高度敏感性和特异性,多项研究显示在SFT/HPC中STAT6阳性率高达96%以上。其余抗体在不同的WHO级别表达情况有一定差异,大部分病例,尤其是WHOⅠ级病例,弥漫表达波形蛋白、CD99、CD34及Bcl-2,Ⅲ级肿瘤弱表达甚至不表达CD34。本例患者STAT-6(+)、CD99(部分+)、CD34(-),符合Ⅲ级表现。
临床上,SFT/HPC男性多见,男女比例可达2∶1,成人多见。中枢系统的SFT/HPC表现可能有头痛、呕吐、肢体乏力、抽搐、视力下降等常见中枢神经系疾病症状,临床表现与肿物位置相关,主要症状为头痛,偶见以自发性颅内出血起病。颅内Ⅱ-Ⅲ级孤立性纤维性肿瘤/血管外皮细胞瘤预后不良,可颅外转移至骨骼、肝脏及肺等,也有报道转移至肾上腺、肾及乳腺等脏器,颅外转移可达28%,治疗首先手术全切或扩大切除,术后辅助放疗,完整切除和接受术后放疗的患者PFS更长。
本例患者放疗后颅内强化结节明显缩小,水肿显著减轻且未出现放疗相关颅神经损伤。预后方面,中枢系统的SFT/HPC的复发率约37%,高级别者更容易复发,可高达83%,生存率更低且远处转移率约10%,且低级别的SFT/HPC可以发展为高级别。Sung回顾分析了60例病人,中位OS为73.2月,第一次手术后PFS为53.8月。
影像学方面,特点为病变位于颅内脑外,幕上多见,主要发生部位为镰旁、颅底及天幕等硬脑膜或静脉窦旁,也可发生于脑室和脑池;多为单发肿块,边界清晰,较小者多为类圆形或椭圆形及结节状,较大者可有分叶或不规则形,Ⅱ-Ⅲ级肿瘤具有侵袭性,多呈分叶状。MRI信号混杂,T1WI呈等、稍低或混杂信号,T2WI多呈等或稍高信号。若T2WI瘤内出现低信号影且增强扫描后明显强化,此与瘤体内含致密的胶原纤维成分有关,可提示诊断。Ⅱ-Ⅲ级肿瘤DWI多呈等低信号,与瘤内伴有囊变、坏死有关,瘤内出血及钙化少见;肿瘤血供丰富,瘤周常伴水肿。
SFT/HPC术前误诊率较高,最常误诊为脑膜瘤,有误诊率高达75%,本例当地医院考虑肿瘤伴瘤卒中,我院病理诊断为(脑)骨外尤文肉瘤/原始神经外胚叶肿瘤,均存在误诊情况。
综上所述,中年以上颅内脑外肿瘤,外形不规则、有明显分叶或见蘑菇状结节,肿瘤内有坏死、囊变,与脑膜窄基底相连,增强扫描强化明显且持续,有丰富的血管流空,邻近骨骼侵蚀破坏,应考虑本病可能。确诊需要结合临床资料、影像学检测、免疫组化及染色体检查。治疗首选手术完整切除,术后建议辅助放疗。