电压门控钠通道是细胞膜兴奋性的重要控制因素,对各种生理和神经过程起着基础性作用。这些通道是一些重要药物的主要作用靶点,包括局部麻醉剂、抗癫痫药、抗心律失常药和止痛药。
最近,普林斯顿大学和清华大学的研究团队在PNAS上发表了一项研究,揭示了人类Nav1.7通道与两种抗癫痫药物利鲁唑(RLZ)和拉莫三嗪(LTG)的结合结构,分辨率分别为2.9 Å和2.7 Å。此外,他们还获得了无配体Nav1.7的三维EM结构,分辨率为2.1 Å。
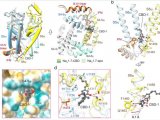
研究发现,RLZ位于通道的中央空腔中,由重复序列III和IV的残基共同协调。而LTG则以一种双口袋机制阻断Nav通道,一个LTG分子位于中央空腔,另一个位于胞内门下方的BIG位点。这些研究结果还解释了LTG与不同Nav通道的疗效和亚型选择性之间的结构-活性关系。
总的来说,这项研究揭示了这些药物在分子水平上如何作用于Nav通道,这有助于未来开发新的抗癫痫和止痛药物。
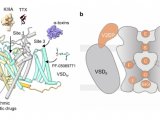
2023年6月,来自普林斯顿大学、清华大学以及哈佛医学院的科学家合作发现了大麻二酚(CBD)对电压门控钠通道(Nav1.7通道)的影响。这项研究发表在Nature Communications上。研究结果表明,CBD在极低浓度下以状态依赖方式与Nav1.7通道相互作用,特别是与通道的失活状态。电生理实验显示,CBD的离解常数约为50 nM。此外,通过冷冻电镜结构,科学家们揭示了CBD与Nav1.7通道的两个不同结合位点,一个位于上孔附近的IV-I孔中,另一个则靠近重复序列III和IV之间的失活位点。这些发现为设计更有效的CBD相关化合物提供了指导。

另一项研究在Nature Communications上发布,由清华大学和普林斯顿大学的研究人员合作完成。该研究报告了使用具有代表性化学骨架的药物和先导化合物处理过的人类Nav1.7的高分辨率冷冻电镜结构,分辨率在2.6-3.2 Å之间。这有助于更好地理解Nav1.7抑制剂的结构和作用方式。
此外,早在2023年1月,普林斯顿大学和清华大学的研究人员揭示了人类电压门控钠通道Nav1.6的冷冻电镜结构。这项研究显示了Nav1.6通道在存在辅助亚基β1和成纤维细胞生长因子同源因子2B(FHF2B)的情况下的结构,总体分辨率为3.1 Å。这个研究有助于深入了解Nav1.6通道的结构,有望为开发特异性阻滞剂提供指导,并帮助理解与疾病相关的Nav1.6突变的致病机制。
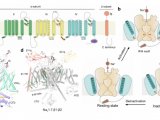
电压门控钠(Nav)通道在多种生理过程中扮演着关键角色,包括肌肉收缩、感觉知觉和神经递质释放。这些通道由成孔的α亚基组成,包括一个离子传导孔域(PD)和四个电压感应域(VSDs),同时伴随辅助β亚基来调节通道的功能和位置。然而,Nav通道的功能异常与多种疾病有关,如癫痫、心律失常、神经性疼痛和自闭症。尽管已经开发了多种Nav通道抑制剂,包括局部麻醉剂、抗癫痫药、抗心律失常药和止痛药,但这些药物通常效果中等,而且在不同的Nav亚型中缺乏选择性,可能导致不必要的副作用。因此,最近的Nav药理学研究着重于开发新一代阻滞剂,以提高治疗效果和亚型选择性。
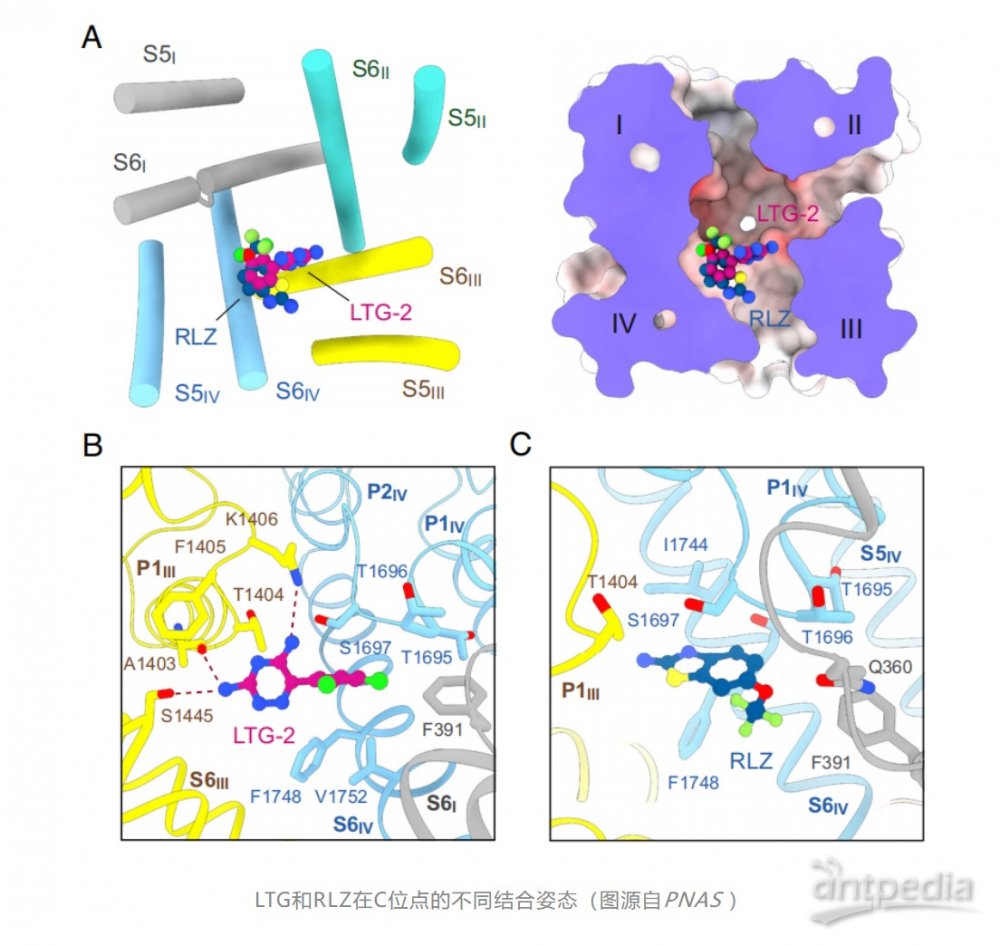
举例来说,拉莫三嗪(Lamictal®)是FDA批准的治疗癫痫和双相情感障碍的药物,而利鲁唑(Rilutek®)则是用于治疗肌萎缩侧索硬化症等疾病的药物。尽管对这些药物作为非选择性Nav通道抑制剂的研究很广泛,但它们与Nav通道的结合机制仍不清楚。最新的研究使用高分辨率冷冻电镜分析,探究了这些药物与Nav1.7通道的结合方式。研究发现,拉莫三嗪和利鲁唑通过双口袋机制阻断Nav通道,其中一个拉莫三嗪分子位于通道的中央空腔,另一个位于胞内门下的BIG位点。这些研究结果还提供了关于线性6,6系列的结构-活性关系的见解,这些序列可用于提高不同Nav通道的治疗效果和亚型选择性。
总之,这些研究为我们深入了解这些药物在分子水平上如何影响Nav通道提供了重要信息,这将有助于未来的抗癫痫和止痛药物的开发。