近日,中华全国总工会将2024年全国五一劳动奖和全国工人先锋号拟表彰对象予以公示。其中,深圳医学科学院院长、深圳湾实验室主任、教授颜宁拟获全国五一劳动奖章。

“全国五一劳动奖章”是全国总工会为奖励在社会主义各项建设事业中作出突出贡献的职工而颁发的荣誉奖章。被授予“全国五一劳动奖章”的职工,由全国总工会颁发奖章、证书和奖金。
稍早前,颜宁已进入广东省总工会关于广东省2024年全国五一劳动奖和全国工人先锋号拟推荐对象的公示名单中。
据广东省总工会提供的资料,颜宁,女,汉族,1977年11月生,群众,现任深圳医学科学院院长、深圳湾实验室主任、清华大学讲席教授、中国科学院院士。
颜宁主要致力于跨膜运输蛋白的结构与机理研究,在国际上首次揭示人源葡萄糖转运蛋白、真核生物电压门控钠离子通道和钙离子通道等一系列具有重要生理与病理意义跨膜蛋白的原子分辨率结构,为理解相关疾病的致病机理及药物开发提供了分子基础。其科研成果获得海内外同行广泛认可。
她推动深圳医学科学院各项建设。完成深圳医学科学院筹建,于2023年10月获批正式成立。受市政府委托管理深圳市医学研究专项资金,完成首年评审与立项,资助总金额近2亿元。引进美国冠名讲座教授陈宙锋等7位学术带头人。举办7次SMART Symposia,邀请数位诺奖得主在内的100余名中外院士、顶尖专家汇聚光明科学城。成立深圳市光明致远科技基金会。
她推进深圳湾实验室高质量发展。打造多维度科研评估体系,对PI全覆盖开展国际化学术评估,对研发管线项目和特色技术平台进行评审。引进海内外一流人才达100余人,获批博士后独立招收资格,获科技部引才引智示范基地、广东省科普教育基地等荣誉称号10多项。
PNAS 、Cell 颜宁团队接连发表高水平文章
今年以来,颜宁教授领导的清华大学/深圳医学科学院团队在PNAS、Cell等高影响因子期刊上发表了多篇高水平的科研文章,进一步证明了她在科研领域的深厚实力和突出成就。
以下是部分最近研究发表:
2024年4月11日——
清华大学/深圳医学科学院颜宁团队在Cell Research(IF=44)在线发表题为“Structural basis for human Cav3.2 inhibition by selective antagonists”的研究论文,该研究展示了Cav3.2单独和与四种T型钙通道选择性拮抗剂复合物的冷冻电镜结构,总分辨率从2.8 Å到3.2 Å。这四种化合物表现出两种结合姿态。
ACT-709478和TTA-A2均将其含环丙基的末端置于中心腔中,直接阻断离子流动。TTA-P2和ML218将其3,5-二氯苯酰胺基团投射到II-III孔中,并将其疏水尾部放置在腔中以阻止离子渗透。穿孔穿透模式立即为这些拮抗剂的状态依赖性活动提供了解释。结构导向突变分析确定了决定这些药物T型偏好的几个关键残基。这些结构也表明内源性脂质在稳定药物在中央腔内结合中的作用。

电压门控钙(Cav)通道响应膜去极化,允许Ca2+内流并将电信号转化为细胞内Ca2+介导的事件。它们在Ca2+依赖的生理过程中发挥重要作用,如神经递质/激素释放、基因表达和肌肉收缩。钙通道活性的精确控制涉及多种细胞因子,如受体、钙调蛋白、磷脂和G蛋白。此外,这些通道可以被一系列离子、毒素和许多临床和研究药物调节。
在哺乳动物的10种Cav亚型(Cav1.1-Cav1.4、Cav2.1-Cav2.3和Cav3.1-Cav3.3)中,Cav3亚家族也被称为T型钙通道,与大而持久的l型Cav1通道相比,其特点是电流微小且短暂。与需要多个辅助亚基来进行通道活动的Cav1和Cav2成员不同,T型通道独立起作用。此外,Cav1和Cav2通道在高压下被激活,因此也被称为高压激活(HVA)通道,而Cav3通道是低压激活(LVA)通道。LVA和HVA通道之间的序列差异很大程度上支持了它们的功能差异,为开发亚型特异性调节剂提供了潜在药物发现的机会。

人Cav3.2的冷冻电镜结构分析(图源自Cell Research )
Cav3.2由CACNA1H编码,广泛表达于中枢神经系统,调节神经元兴奋性,参与伤害感受。其活性的改变与许多神经和神经精神疾病有关,包括特发性全身性癫痫和疼痛。研究表明,在各种炎症性和神经性疼痛模型中,脊髓背角和背根神经节神经元中Cav3.2的表达和/或活性增加沉默或药物抑制Cav3.2通道可诱导啮齿动物镇痛。因此,Cav3.2正在成为下一代镇痛药开发的一个有希望的药物靶点。靶向Cav3.2的化合物,如乙磺酰亚胺、米贝弗拉迪、丙戊酸、唑尼沙胺、吡莫胺和某些二氢吡啶(DHPs),在啮齿动物急性、炎症和慢性疼痛模型中显示出疗效。
目前正在研究各种具有新型化学骨架的小分子作为潜在的镇痛候选药物,如Z944、TTA-A2、TTA-P2、ML218和ACT-709478。与通常对T型通道特异性有限的已批准药物相比,这些正在研究的T型特异性阻滞剂对T型Cav通道具有更强的亲和力。尽管这些化合物尚未区分T型亚型,但与Cav3.1和Cav3.3相比,Cav3.2独特的药代动力学特性为开发真正的Cav3.2选择性分子提供了机会。
获得与FDA批准的药物或先导化合物复合的通道结构的高分辨率洞察对于指导从头药物设计或优化至关重要。Cav3.1结合先导化合物Z944的结构揭示了T型钙通道的基本结构和Z944.44状态依赖性抑制Cav3亚家族的分子基础。最近关于Cav3.3与米贝弗拉迪、吡莫胺和奥替溴铵配合物结构的报道拓宽了靶向T型钙通道的药物识别谱。该研究试图确定人类Cav3.2单独和与代表性拮抗剂复合的结构,特别关注那些对T型钙通道具有增强选择性的结构。
3月28日——
2024年3月28日,清华大学/深圳医学科学院颜宁、清华大学闫创业及潘俊敏共同通讯在Cell 在线发表题为“Structure-guided discovery of protein and glycan components in native mastigonemes”的研究论文,该研究报道了从莱茵衣藻纤毛中分离的天然纤绒毛 (Mastigoneme) 3.0 Å分辨率的冷冻电镜结构。
长茎形成一个超级螺旋,每个螺旋旋转由四对反平行的纤绒毛素样蛋白1 (Mst1)组成。在Mst1中,在II型聚羟基脯氨酸(Hyp)螺旋周围发现了大量阿拉伯糖聚糖,它们代表了植物和藻类中常见的一类糖基化。EM图谱揭示了纤绒毛轴心蛋白(Mstax),该蛋白富含重度糖基化的Hyp,并含有PKD2样跨膜结构域(TMD)。Mstax有近8000个残基,从细胞内区域到纤绒毛素的远端,为Mst1的组装提供了框架。该研究提供了对天然生物结构中蛋白质和聚糖相互作用复杂性的见解。

纤毛,或鞭毛,突出到细胞外环境服务于双重目的检测环境的变化和促进细胞运动。一些单细胞原生生物的纤毛排列有侧毛,称为纤绒毛。先前的研究表明,纤绒毛可能参与机械刺激的感知。它们还可以通过增加纤毛在蛙泳运动时的有效表面积来增强纤毛推进力。
有管状和非管状纤绒毛。管状纤绒毛属通常长1毫米,直径15-19纳米,相对坚硬,而非管状纤绒毛属较短(0.8毫米),较薄(10纳米),柔韧,易脱落。衣单胞菌纤毛上的非管状纤绒毛素被认为与多囊肾病蛋白(PKD2)(也称为多囊素-2 [PC-2])有关,多囊素-2是一种瞬时受体电位(TRP)家族通道,其跨膜区域共享电压门控离子通道(VGIC)折叠。在哺乳动物细胞的初级纤毛上,PKD2的三个亚基与PKD1(也称为PC-1),(具有巨大的多结构域胞外区域)组合形成异源四聚体。然而,PKD1/PKD2异构体的生理功能尚不完全清楚,该异构体是否具有通道活性仍存在争议。预测衣藻上的纤绒毛是由重度糖基化的纤绒毛样蛋白1 (Mst1)组成的螺旋状聚合物。由于纤绒毛的高分辨率结构的缺乏,完整的组件,准确的组装,以及与PKD2潜在相互作用的细节仍然是未知的。此外,聚糖的结构或功能作用仍然难以捉摸。
糖基化是翻译后修饰(PTM)的一种主要形式,它显著地扩展了蛋白质的结构复杂性和功能多样性。糖化蛋白参与多种生物过程,如信号传导、免疫反应和细胞分化。在核酸、蛋白质、脂质和碳水化合物这四种主要的生物分子中,后两者是结构生物学最具挑战性的目标。糖基化通常通过点突变或去糖基化来去除,以改善基因的均匀性蛋白质结晶。使用单粒子冷冻电镜(cryo-EM)进行结构分析,可以保存糖基化。然而,由于多糖链固有的柔韧性,在EM图中只能分辨出靠近修饰残基的几个糖基。碳水化合物结构信息的缺乏严重限制了人们对一类主要生物分子的理解。

机理模式图(图源自Cell )
为了扩大人们对糖蛋白和天然生物结构的了解,作者利用单粒子冷冻电镜(cryo-EM)研究了莱茵衣藻(Chlamydomonas reinhardtii)内源纤绒毛的组装,并获得了3.0 Å的重建。除了交织在一起的Mst1原纤维的高阶低聚物外,出色的EM图谱还能够鉴定出作为纤绒毛中心轴的蛋白质。研究人员将这种高度糖基化、富含羟脯氨酸(Hyp)的大蛋白命名为纤绒毛特异性轴蛋白Mstax。对Mstax未解析片段的结构预测显示,在近膜区和跨膜区存在PKD2样褶皱,从而为纤绒毛和PKD2之间的相互作用提供了合理的分子基础。该研究提供了对天然生物结构中蛋白质和聚糖相互作用复杂性的见解。
3月5日——
2024年3月5日,清华大学/深圳医学研究院颜宁团队在Cell Research 在线发表题为“Structural basis for different ω-agatoxin IVA sensitivities of the P-type and Q-type Cav2.1 channels”的研究论文,该研究揭示了不同ω-agagoxin IVA灵敏度的P型和Q型Cav2.1通道的结构基础。
该研究报告了Cav2.1单独和与MVIIC或Aga-IVA复合物的冷冻电镜结构,总分辨率为2.9-3.1 Å。这些结构揭示了两种选择性肽毒素选择性抑制Cav2.1的分子决定因素,为亚型特异性治疗的发展奠定了基础。

由CACNA1A编码的P/Q型Cav通道Cav2.1普遍存在于神经元和神经内分泌细胞中,在神经递质的释放、突触可塑性和神经元兴奋性的调节中起重要作用。Cav2.1是治疗神经系统疾病(如癫痫和偏头痛)的潜在治疗靶点P/Q型的定义源于它们最初分离的细胞类型,P型来自小脑浦肯野细胞,Q型来自小脑颗粒细胞。P/Q类型可以通过不同的失活动力学和对ω-agatoxin IVA (Aga-IVA)的不同敏感性来区分Aga-IVA可有效阻断P型通道,kD值为1 ~ 2 nM,而Q型通道的敏感性较弱。有报道称,在第四个电压感应域(VSD)连接S3和S4片段的环中插入Asn-Pro (NP)基序的CACNA1A的选择性剪接(在VSDIV中称为S3-4IV环)可显著降低Aga-IVA的敏感性。除AgaIVA外,ω-concontoxin MVIIC (MVIIC)可选择性有效抑制P/Q型通道。
研究人员首先检测了人Cav2.1全长在α2δ-1和β3辅助亚基存在下的通道活性。电压相关的Ba2+ (IBa)电流的稳态激活和失活特性分别为-9.64 ± 0.30 mV和-63.08 ± 0.98 mV。结构分析显示,MVIIC在选择性过滤器(SF)上方的外口被明确地分离出来,Aga-IVA附着在VSDIV的细胞外周。为简化说明,将Cav2.1与MVIIC和Aga-IVA的复合物分别称为Cav2.1-M和Cav2.1-A。
Cav2.1的整体结构与Cav2.2和Cav2.3非常相似,具有一个低的VSDII和一个磷脂酰肌醇4,5-二磷酸(PIP2)分子结合在VSDII和孔域(PD)之间的间隙上。PD闭合的胞内门进一步由Cav2特有的重复序列II的细胞质螺旋(CHII螺旋)保护。尽管整体结构相似,但某些区域,特别是重复序列I和IV中的细胞外环(ECLs)存在明显差异,这与这些区域的序列变化一致。ECLs中的差异是Cav2通道对各种肽毒素的独特敏感性的基础。

Aga-IVA和MVIIC亚型选择性抑制Cav2.1的结构基础(图源自Cell Research )
在Cav2.1-M的结构中,MVIIC位于SF的正上方,有效地阻断了Ca2+的进入途径。这种作用机制类似于MVIIC对Cav2.2的作用机制。MVIIC与Cav2.1的相互作用主要由P1和P2螺旋上的极性残基和带电残基以及ECLs介导。Cav2.1-M和Cav2.1-A的结构比较表明,ECLI和ECLIV都略微向外移动以容纳MVIIC。在Cav2.2中,MVIIA结合后也观察到类似的运动然而,局部结构的变化可能并不总是足以创造空间兼容性。事实上,在Cav2.1和Cav2.3之间,ECLI和ECLIV的序列和结构都有很大的不同。Cav2.3的ECLI更靠近中轴线,可能与MVIIC产生不可避免的冲突。这就解释了Cav2.3对MVIIC不敏感的原因。
值得注意的是,Cav2.2和Cav2.3中的S3-4IV环差异很大,这解释了它们对Aga-IVA不敏感的原因。Aga-IVA粘附于含有NP的S3-4IV环的结构观察,从而解释了不同Cav2亚型和Cav2.1剪接变异体的不同敏感性的物理基础。结构比较显示,在Aga-IVA结合时,S4IV向胞内侧轻微向外运动,S4IV向胞内侧半螺旋旋转运动。由于Cav通道中的VSDs在静息状态下应呈“下”构象,结构观察表明Aga-IVA可能通过抑制VSDIV的激活来阻断通道。综上所述,该研究揭示了MVIIC和Aga-IVA对Cav2.1亚型特异性阻断的分子机制,为P型和Q型Cav2.1通道对Aga-IVA的不同反应提供了结构解释,并为开发更有效和选择性的神经疾病调节剂提供了见解。
2月21日——
清华大学/深圳医学科学院颜宁团队在PNAS 在线发表题为“Dissection of the structure–function relationship of Nav channels”的研究论文,为了描述人类Nav通道的结构-功能关系,该研究以人类Nav1.7为原型进行了系统的结构分析。根据野生型(WT) Nav1.7与含有11个突变的变体Nav1.7 -M11之间的结构差异,该研究生成了另外三个中间突变体,并以2.9-3.4 Å的总分辨率求解了它们的结构。
在孔域(PD)上有9个点突变的突变体被命名为Nav1.7-M9,其空腔体积减小,门密封,所有电压感应域(VSD)保持在上。WT和Nav1.7-M9的结构比较指出了两个可能对PD收紧至关重要的残基。然而,包含这两个突变的变体Nav1.7-M2,甚至与VSD中另外两个突变Nav1.7-M4结合,都未能使PD收紧。该结构分析表明,静态失活I-V曲线的右移与PD收缩的趋势相关。研究人员预测静息状态下的通道应该有一个“紧”的PD和低的VSD。

真核电压门控钠(Nav)通道通过以动作电位的形式启动和传播电信号来控制膜的兴奋性。在静息状态下,可兴奋细胞(如神经元和肌细胞)的膜呈负电位极化。静止状态下的Nav通道是不导电的。它们响应膜去极化而激活。确保动作电位重复放电的关键机制是Nav通道的快速失活,这种失活发生在激活后的一毫秒或几毫秒内。失活通道在膜超极化后返回静息状态,为下一个工作周期做准备。
由于其在生理学上的基础意义,钠通道的异常功能或调节与大量的致病性疾病有关,如癫痫发作、心律失常和疼痛障碍。因此,Nav通道代表了一类主要的药物靶点。不同功能状态下NaV通道的结构解析不仅对深入了解电信号的基本生理过程至关重要,而且对NaV靶向药物的开发也至关重要。
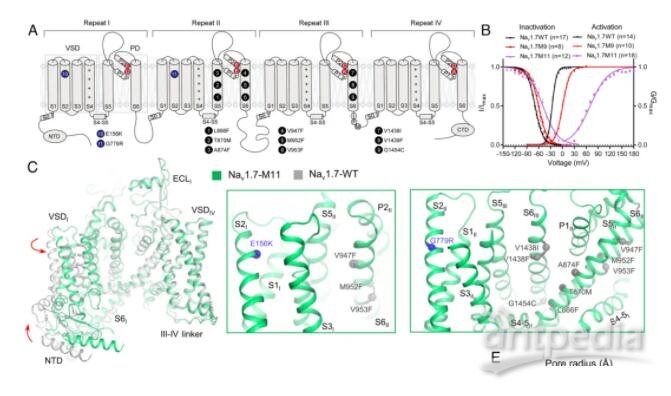
结构-功能关系研究中Nav1.7变体的合理设计概览(图源自PNAS )
与其他电压门控阳离子通道一样,Nav通道由两个模块组成,一个是负责选择性和门控离子渗透的中心孔域(PD),另一个是检测膜电位变化并相应地发生构象变化的电压感应域(VSDs)。一般认为,静息状态下的Nav通道具有一个封闭的PD,有四个“向下”的VSD,其中S4段上的门控电荷残基面向胞内侧。Nav通道的激活是指由VSD向上运动引起的孔打开。具有孔门控的VSD协同运动被称为机电耦合。从物理角度来看,NaV本质上是多个构象的集合,每个构象都可以由调制器特定地识别。
到目前为止,人类Nav通道的八个亚型的结构,Nav1.1-Nav1.8已被报道。然而,大多数报道的结构表现出类似的失活构象,具有非导电PD和四向上VSD的特征。Nav通道结构生物学的主要挑战是揭示机电耦合过程中与不同状态相关的构象。为了实现这一目标,研究人员一直在使用人类NaV1.7作为支架,并利用多种策略,如引入点突变和包含状态依赖性毒素或药物。

Nav通道PD的结构-功能关系(图源自PNAS )
最近的一项尝试是用NavPaS的对应物合理地替代一些Nav1.7残基,这是第一个确定原子结构的真核Nav通道。与人类的Nav通道相比,NavPaS异构体的结构与人类的Nav不同,PD更收缩,VSDs处于中间状态。当Nav1.7的PD上的9个位点被NavPaS的残基取代时,得到的变体Nav1.7-M9(简称M9)在激活和静态失活时都显示出右移的I-V曲线。当与VSDI和VSDII的另外两个突变结合时,变体Nav1.7-M11的这些I-V曲线的右移更为显著。基于这些I-V曲线,研究人员预测纯化后的M11在没有任何膜电位的情况下,可能是封闭状态失活(CSI)构象。事实上,M11-class I的结构与野生型通道(Nav1.7-WT)有很大的差异。此外,VSDII通过一个门控电荷向细胞内移动。为简单起见,除非另有说明,否则NaV1.7-M11或M11将参考M11 -I类的结构。
该研究试图剖析11个点突变对WT和M11之间结构变化的贡献。除了M9,该研究还生成了两个额外的变体,Nav1.7-M2包含两个PD突变,其衍生物Nav1.7-M4与M11一样具有两个额外的VSD突变。该研究对这些Nav1.7突变体的系统结构检查提供了Nav1.7通道结构-功能关系的最新观点。这些结构突出了PD与非导电态相关的构象复杂性。