心血管疾病(CVD)是西方国家死亡和发病的主要原因。糖尿病与心血管疾病有着非常密切的关系,但传统心血管疾病危险因素在2型糖尿病患者中预测能力有限。血糖控制程度是2型糖尿病患者心血管疾病发病风险的预测指征,但单纯使用抗糖尿病药物(降低血糖水平)无法有效降低心血管疾病的发展或严重不良心血管事件(MACE)风险。由此可见,两者相互关系中仍然有许多问题悬而未决,亟需对糖尿病和心血管疾病的代谢新途径进行更深入的了解。
2020年3月5日, 克利夫兰诊所Stanley Hazen研究团队在Cell期刊(IF=36.216)在线发表题为“A Cardiovascular Disease-Linked Gut Microbial Metabolite Acts via Adrenergic Receptors”的研究成果。研究人员以非靶向代谢组学作为发现平台,结合功能研究,发现PAG这种由肠道微生物产生的化合物可以调节肾上腺素受体,揭示了食物是如何通过肠道微生物与健康和疾病风险联系在一起的, 这可能为未来个体化的心血管疾病诊治提供帮助。
研究路线

研究结果
1. 非靶代谢组学:确证苯乙酰谷氨酰胺PAGln与CVD相关
首先,作者对初始发现队列(n=1162)的血浆进行非靶向代谢组学分析【结合临床数据:选择性心脏诊断评估、3年随访记录,包括主要不良心脏事件(MACE=心肌梗死(MI) 、中风或死亡) 、血糖水平、血糖控制指数对代谢物进行优先排序】。结果显示:与MACE预测相关的候选代谢物中, 排名前5的代谢物分为2类:已知结构和未知结构的化合物,其中未知化合物m/z 265.1188在(3年)MACE风险的危险比(HR)为95%(图1A和1B)。随后作者通过多种方法确证该物质为苯乙酰谷氨酰胺PAGln(图1C)。
接下来,作者利用基于质谱的靶向检测方法对独立的4000例受试者(验证队列)血浆进行分析,发现患有2型糖尿病的受试者血浆中含有较高的PAGln水平(与非糖尿病患者相比,p=0.0002),患有MACE的受试者血浆含有较高PAGln水平(与非MACE患者相比,p<0.0001)。Kaplan-Meier生存分析显示PAGln水平高的受试者发生MACE的风险更大(3年)(图1D),此外,对传统心脏危险因素进行调整后,较高PAGln水平仍然可以作为发生MACE风险的独立预测因子(图1E)。

图1 非靶向代谢组学研究发现m/z 265.1188的代谢产物与心血管疾病风险相关,被鉴定为苯乙酰谷氨酰胺
2. 功能验证:肠道菌群参与体内PAGln和苯乙酰甘氨酸PAGly的产生
为了探究这种物质在体内是如何产生的?根据前人研究结果:肠道菌群参与体内氨基酸的代谢,故研究者在人类受试者和小鼠身上展开实验,比较口服抗生素混合物处理前后血浆中PAGln含量,发现在人类中,PAGln的循环水平比PAGly高出一个数量级。相比之下,小鼠的PAGly水平比PAGln高一个数量级,经腹腔注射的PAA主要代谢为PAGly,肠道微生物群是PAA形成PAGly的关键参与者(图2B-D)。因此,在人和小鼠体内,PAGln和PAGly都是通过一种代谢途径产生的,其中膳食苯丙氨酸Phe通过肠道微生物群转化为苯乙酸PAA,此时,宿主结合反应分别与Gln(人类首选)或Gly(啮齿动物首选)发生,产生PAGln和PAGly(图2E) 。

图2 体内PAGln的产生在人和小鼠体内是一个微生物依赖的过程
3. 表型验证1:PAGln增强血小板刺激引起的钙释放及对多种激动剂的聚集反应性
血液中的PAG以多种不同方式增加了心血管疾病的风险。研究者提取了患者样品中的全血、富含血小板的血浆以及分离出来的血小板进行分析,观察在生理剪切力作用下,PAGln是否影响血小板粘附于胶原表面。结果表明:PAGln显著加速胶原蛋白依赖性血小板粘附和扩散的速度(图3A-3C),在生理范围内,PAGln呈剂量依赖性地增强PRP中血小板聚集的程度(图3D)。在分离的血小板中发现:PAGln也呈现剂量依赖性最大量的增强ADP刺激的P-选择素表面表达(图3E)和糖蛋白a2b3(GP-IIb/IIa)活性,PAGln水平大于等于10 mM时血小板活化表型显著增加。以上结果提示PAGln可能直接与血小板相互作用,促进细胞内Ca2+浓度([Ca2+])的刺激依赖性升高。
为了直接验证这一点,从健康供体中回收分离的人血小板,并负载钙离子荧光探针Fura2-AM,在凝血酶诱导活化前后实时监测PAGln对[Ca2+]的影响。单用PAGln预孵育血小板对基线[Ca2+]水平没有影响(图3G)。然而,暴露于生理水平的PAGln可剂量依赖性次最大量促进凝血酶诱发[Ca2+]的增强(图3G)。上述数据表明,肠道微生物群依赖性代谢产物PAGln和PAGly显著影响血小板功能,增强血小板与胶原基质的粘附,并促进血小板刺激依赖性[Ca2+]的升高和激动剂引起的聚集反应。

图3 PAGln增强血小板反应性
4. 表型验证2:PAGln促进血小板凝块的形成并提高体内血栓形成潜能
采用FeCl₃诱导的颈动脉损伤模型,研究PAGln和PAGly对体内血栓形成的影响。小鼠经腹腔注射PAGln或PAGly后,PAGln和PAGly均诱导损伤颈动脉内血小板血栓形成增加(图4A),与营养前体Phe或生理盐水治疗的小鼠相比,相应地缩短了损伤后停止血流的时间(即闭塞时间)(图4B)。则可以更加直观地看到,PAG让血管内形成血栓的可能性加大。而血栓众所周知是造成心肌梗死和卒中的主要危险因素。
5. 机制探究1:肠道微生物基因porA和fldH在体内调节宿主血栓形成潜能
为了探究宿主体内促进PAGln/PAGly生成的共有体和基因是否具有调节血小板功能和体内血栓形成的潜能,文献调研发现:产孢梭菌porA基因和fldH基因与Phe向PAA氧化代谢中有关。故在ΔcutC基因敲除的背景下,构建了ΔcutCΔfldH、ΔcutCΔporA两个干扰突变株进行功能鉴定。发现在ΔcutCΔfldH突变菌株孢子母细胞定植的GF小鼠,其PAGly水平显著高于对照ΔcutC突变菌株孢子母细胞定植小鼠(图4D)。动脉损伤后,感染ΔcutCΔfldH突变菌株孢子母细胞的小鼠血栓生成率和损伤血管内血流停止时间均显著降低,产生更高水平的PAA(图4D)。上述证据表明肠道微生物基因porA和fldH在体内调节宿主血栓形成潜能。

图4 PAGln与PAGly增强体内血栓形成潜能
6. 机制探究2:PAGln通过G蛋白偶联受体介导细胞事件
PAGln表现出与细胞的受体-配体相互作用特性,研究者进一步探究PAGln诱导的DMR细胞反应是否会受到已知的GPCR信号通路调节剂的影响,采用3种GPCR信号通路调节剂和1种抑制剂处理细胞,发现PTX、CTX和YM-254890预处理MEG01细胞,或使用GPCR抑制剂SCH-202676处理,均明显降低了PAGln诱导的DMR反应, Gln诱导的MEG01和HEL92.1.7细胞DMR反应似乎是通过对一个或多个GPCRs饱和和特异性反应介导的(图5A-B)。进一步检测细胞内cAMP或[Ca2+]变化,发现PAGln确实引起了MEG01细胞(图5C)和分离的人血小板(图5D)中cAMP短暂(5分钟内)显著性的增加(约20%-30%),此外,用已知的GPCR调节剂预处理显示CTX或GPCR抑制剂SCH202676抑制PAGln诱发的cAMP生成,提示PAGln暴露触发了Gαs介导的腺苷酸环化酶的激活。

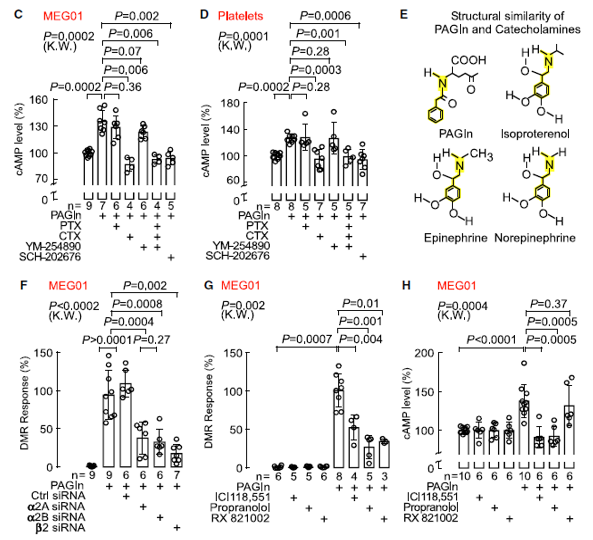
图5 PAGln通过G蛋白偶联受体和ADR介导细胞反应
7. 功能验证:PAGln通过ADRs发挥作用
研究人员进一步破译PAG促进细胞事件的分子机理,使用遗传和药理学方法对G蛋白偶联受体(包括α2A,α2B和β2-肾上腺素受体)进行的功能获得和功能丧失研究,结果表明PAGln可通过α2A,α2B和β2-ADRs诱导细胞反应。
在普萘洛尔、ICI118551或RX821002存在下暴露PAGln可减弱PAGln诱导的血小板高应答反应,每一个ADR抑制剂的加入都能逆转PAGln引起血小板高应答反应。在动脉损伤的小鼠模型,不使用卡维地洛(Carvedilol)β-受体阻滞剂治疗的情况下,PAGln再次显著加快了血小板血栓形成的速度(图6D),并缩短了停止血流的时间(图6E),给血液内高PAG水平的小鼠使用了β受体阻滞剂卡维地洛(Carvedilol)后,果然显著降低了PAG促发的高血栓风险。综上所述:高水平PAG促进心血管表型的出现,给予β受体阻滞剂可以逆转PAG诱导的不良表型,认为β受体阻滞剂带来的一些获益可能源自其逆转高水平PAG的效应。

图6P AGln通过ADRs调节血小板功能和体内血栓形成的潜能
小结
该研究对1162名受试者使用非靶向代谢组学方法,发现了血浆代谢物(m/z = 265.1188)苯乙酰谷氨酰胺(PAGln),并在独立队列(n= 4,000名受试者)中发现其与心血管疾病(CVD)和重大不良心血管事件(心肌梗塞,中风或死亡)相关。在全血、分离的血小板和动脉损伤动物模型中验证发现:肠道菌群衍生代谢物PAGln可增强血小板活化相关的表型和促进血栓形成。进一步对人类共生菌的功能和基因研究以及对无菌小鼠进行微生物定植的研究,结果表明微生物porA基因有利于食物中的苯丙氨酸转化为苯乙酸,随后宿主产生PAGln和苯乙酰基甘氨酸(PAGly)可促进培养血小板的反应性和血栓形成。使用遗传和药理学方法进行的功能获得和功能丧失研究均表明,PAGln通过G蛋白偶联受体(包括α2A,α2B和β2-肾上腺素受体)介导细胞事件,因此,PAGln是一种促进CVD新的肠道菌群依赖性代谢产物,该代谢产物通过肾上腺素受体传递信号。
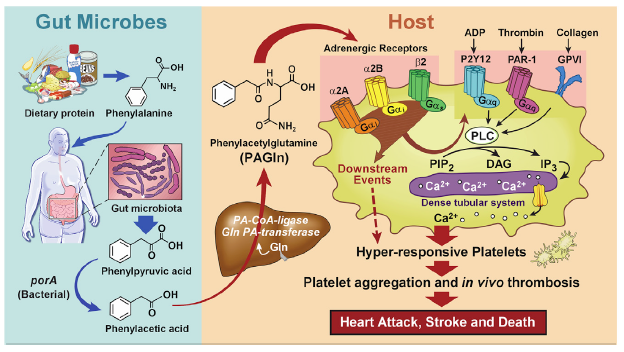
图7 肠道微生物代谢产物PAGln通过ADRs参与血小板血栓形成的研究
历史链接参考
1. 十年磨一剑!EUR HEART J : 大队列靶向脂质组学建立心血管疾病预后新方法
2. 【热门】CNS封面大咖|肠道微生物研究系统解决方案
3. 【热门】紧跟诺奖热点,肿瘤免疫和肠道微生物组成最强CP!
4. 【脂质组】EHJ 重磅!芬兰研究团队联手Mayo Clinic实现脂质标志物临床转化
5. 文献解读 | Circulation:哈佛大学医学院研究团队揭秘慢性肾病患者动脉粥样硬化风险增加新机制
6. 接二连三,看大牛如何做有望实现临床转化的大队列研究
7. 花生四烯酸调节胆固醇平衡,或可作为心血管疾病治疗的作用靶点

微信公众号
中科新生命
提供多组学质谱解决方案