纵观历史,各个国家、各个民族都有过瘟疫席卷后所留下的惨痛历史,如十四世纪四五十年代的欧洲,被称为“黑死病”的鼠疫席卷整个欧洲,夺走了2500万人的性命;大航海时代进入到美洲的天花,也给印第安人带来了沉痛的打击。
随着近代几次工业革命的成功,人类社会迎来了近200年的高速发展,无论是科技、军事、医疗等各个领域都取得了较过去几千年更加璀璨的成果。但时至21世纪的今天,新冠病毒肆虐全球,人类在疾病面前却依然脆弱,全球感染、死亡的人数每天都在上涨,我们能采取的手段却始终是有限且被动的,而新冠病毒在潜伏期的高个体差异,也使得防疫工作变得更加困难。
不仅仅是潜伏期表现的个体差异,现代医学使用以病为本、千人一药的治疗方式也难以完全满足所有病患的需求,因为相同的药物在不同个体身上获得治疗结果也可能由于个体差异而有较大的区别。为了面对未来不可知且变化多端的各种疾病,创新、有效、个性化的疾病预防和治疗手段的发展,才是确保人类健康繁衍的基石。
这时候,我们需要一种更准确有效的医疗手段:精准医学。在前几期的内容里,我们对精准医学这个概念、历史背景以及未来趋势进行了介绍,它以基因测序及相关诊断方式为基础,后续的治疗、用药则根据患者的基因特点、年龄、性别、个性等而不同,是一种更精准、伤害更小的治疗方式。

图片来源:https://knowledge.wharton.upenn.edu/article/precision-medicine-new-paradigms-risks-opportunities/
精准医学具有更好的针对性、高效性和预防性等优势。而精准医学中包括两个重要组成部分,即个性化诊断(诊断设备、基因诊断和免疫诊断等)和个性化治疗(免疫治疗、基因治疗、细胞治疗等),如何做到精准的个性化诊断和有效的个性化治疗,是未来医学手段发展成功与否的重要衡量标准。
大众眼中的基因治疗和细胞治疗
顺着前几期内容方向,这期我们将进一步细化,专门聊一聊有效的个性化治疗。有效性不难理解,个性化治疗的手段也有很多,其中基因治疗、细胞治疗是这些个性化疗法中最有潜力的方法。那么什么是基因治疗和细胞治疗呢?在讲清楚这些概念和背景之前,大部分无专业背景的普通人对这两种治疗方式的认识是模糊的,也很难区分二者之间的关系。
其实大部分人最早接触这些信息可能源于在上个世纪90年代初至中期,那时正处于基因治疗技术发展的“狂热期”,1989年后有100 多个临床方案,经FDA 批准进入临床试验,从专业刊物至一般媒体,给人的印象是基因治疗即将成为临床治疗的一种成熟的治疗方法。这种狂热的形成,既有科学家本身盲目乐观的原因,又与企业界参与以后媒体的炒作相关。
喜欢电影的朋友们或许看过于1997年上映的一部基于当时历史背景的经典科幻电影——《千钧一发》,其讲述了在不远的未来,人类已经完全掌握了基因技术,并实施了大规模的应用。无论是漂亮的外表、强壮的身体、还是强大的免疫能力,想要下一代的夫妇们都可以直接“私人定制”一个宝宝。抛开医学伦理道德来看,这里可以通过基因编辑的手段创造出完美、没有疾病缺陷的人类;目前困扰我们的许多遗传性疾病,如血友病、红绿色盲、肥胖、糖尿病等都可以通过基因工程的手段实现预防性治疗。

图源见水印
大部分人比较熟知的一种属于细胞治疗手段是新生儿脐带血保存。由于近些年来的环境污染、放射线、药物、病毒感染和基因突变等多种因素,造成白血病频发,目前白血病已成为儿童发育期最常见的肿瘤性疾病。因为新生儿的脐带中含有造血干细胞,能够用于重建血液和免疫系统,这对治疗白血病和其他与血液和免疫系统有关的遗传疾病有重要的意义。
真实的基因治疗和细胞治疗
上世纪六七十年代,随着基因操作及DNA重组技术的成熟,基因工程诞生了,这是分子生物学发展的必然结果。基因工程是将目的基因装配于特定的具有表达必备元件的载体中,在体外通过原核细胞或真核细胞进行扩增并表达其目标蛋白质,它的诞生为基因治疗的行成奠定了基础。在随后的1972年,由Fridemann和Roblin首先提出基因治疗的概念,从1989 年,人类史上首例基因治疗临床试验方案在美国被批准实施,至今经过三十多年,基因治疗的发展逐渐成熟。
基因治疗是利用分子生物学方法将目的基因导入患者体内,使之达成目的基因产物,从而使疾病得到治疗,是现代医学和分子生物学相结合而诞生的新技术。传统意义上的基因治疗是指目的基因导入靶细胞后于宿主细胞遗传物质结合,成为其一部分。也有一种方式是目的基因与宿主细胞基因不发生整合,目的基因可得到暂时表达,表达的产物具有一定的治疗作用。
基因治疗中的根据对宿主病变细胞采取的措施不同,分为基因转换、修正、灭活、疫苗等策略。早期的治疗方案仅限于罕见的单基因突变遗传病,如血友病、囊肿性纤维化、肌肉萎缩症和镰状细胞性贫血。因为携带大段DNA并将其置入基因组的正确位置的困难以及研究者对基因治疗的副作用认识不足,基因治疗相关研究进展缓慢,多数临床实验结果不理想,致使很多人失去信心。
随后,基因治疗逐步进入了发展的“理性期”,在2006年以后,基因治疗在科研领域取得很大进展,针对癌症、神经退行性疾病、眼科疾病和心血管疾病等多基因疾病上取得重要成果,均发表在国际顶级期刊上,基因治疗逐渐被学术界所重新认可。

图片来源:https://cn.bing.com/images/search?view=detailV2&id=89E649976A0C900F8605313DEB50C117223CFFD4&thid=OIP.xaiEDhhla8FFhXM0aqxdeAHaEH&mediaurl=https%3A%2F%2Fgeneticliteracyproject.org%2Fwp-content%2Fuploads%2F2016%2F05%2Fgenetherapy-01.jpg&exph=500&expw=900&q=gene+therapy&selectedindex=8&ajaxhist=0&vt=0&eim=0
2017年,美国FDA批准了一种基因治疗产品LuxturnaM,该产品用于治疗由RPE65 基因突变引起的遗传性视网膜疾病。目前,已有数千项有关于基因治疗的临床试验正在全球范围内进行,2019年也有三款基因治疗产品正式进入了市场,分别是治疗脊髓性肌萎缩症的Zolgensma,治疗β-地中海贫血的Zynteglo和治疗闭塞性动脉硬化症和血栓闭塞性脉管炎的Collategene。
而细胞治疗则是利用某些具有特定功能的细胞(正常或生物工程改造过的人体细胞),获取后并通过体外特殊培养的方式进行扩增,使这些细胞具有增强免疫、杀死病原体和肿瘤细胞、促进组织器官再生或替代受损细胞等功能,从而达到疾病的治疗目的。目前按照细胞使用种类,可以分为肿瘤细胞免疫治疗和干细胞治疗。
干细胞是一种具有自我更新能力和多向分化潜能的原始细胞,我们称之为起源细胞,其在一定条件下能够分化为细胞或组织器官。它的分类包括胚胎干细胞(ESC)、成体干细胞(ASC)、癌干细胞(CSC)及诱导多功能干细胞(iPSC)等。其中前面提到的脐带血保存就是利用干细胞(胚胎干细胞)的一种治疗方式。
肿瘤细胞免疫治疗是继手术、放疗、化疗和小分子靶向药物治疗之后的第五大肿瘤治疗技术,目前已经有一定的临床应用,在如癌症、白血病以及帕金森病、心肌梗塞、肝硬化、糖尿病和自身免疫性疾病等的治疗上取得了不错的效果。
基因治疗和细胞治疗有很多共性,如都是以现代分子生物学、生物化学、基因工程理论为基础,都在将有效基因或细胞导入人体中时需要载体的协助等等。所以有许多成功将二者优势融合共同发挥作用的手段,如大名鼎鼎的CAR-T( chimeric antigen receptor T-cell immunotherapy) 细胞疗法。
2012年,6岁的急性淋巴细胞白血病小女孩Emily在无药可医的情况下,尝试了Carl June实验室的研究性CAR-T细胞治疗,奇迹至此发生,治疗后她一直健康的生存至今。CD19 CAR-T细胞治疗自此进入公众视野。它其实就是基因治疗和细胞治疗的一次完美的联合使用,也称之为基因工程化的细胞,其将基因改造后的T 细胞回输至患者体内,生成大量特异性识别肿瘤的CAR-T 细胞从而杀死肿瘤细胞。
目前科学家们正在努力寻找使得CAR-T细胞在实体瘤中有效的方法,如2019年发表于Nature Medicine 期刊上的一篇文章“Clinical lessons learned from the first leg of the CAR-T cell journey”针对如何推动在实体瘤临床研究进展。

图片来自:Nat Med. 2019 Sep;25(9):1341-1355. doi: 10.1038/s41591-019-0564-6.
机遇与挑战
目前,基因治疗和细胞治疗从研发到生成过程中会遇见许多问题,如从实验室放大到GMP规模的病毒载体生产技术平台的建立、基因载体的表征和质量控制、快速简便的细胞质控标准建立等,这些都能成为企业能否第一时间抢占市场的先决条件。
而如何将目的基因安全、有效地导入分离的细胞和人体,是基因治疗和细胞治疗首先需要解决的问题。目前,基因的导入主要通过各种载体实现,载体分为非病毒类载体和病毒类载体,目前最常用的是病毒载体,因为所有的病毒都具备攻击并将其体内的遗传物质导入宿主细胞的能力。
目前个性化治疗主要途径是体内途径和体外途径,其中狭义认知的基因治疗的方式都是通过体内途径,即将外源基因装配于特定的真核细胞表达载体,直接导入体内。这种载体可以是病毒类或非病毒类,甚至是裸DNA直接导入。
体内方式的优势是利于大规模工业生产,缺点是对导入方式下的治疗基因以及其载体必须是安全的,进入体内之后必须能进入靶细胞,有效地表达并达到治疗目的。而体外途径正好与之相反,本身是人体细胞,安全性有很高保证,但是在工业化方面,除载体系统外不易形成规模,同时必须有固定的临床基地。

目前的基因和细胞治疗中,大约只有30%采用了非病毒类载体的导入方式,比较常见的是脂质体载体和裸质粒直接导入。
脂质体优势在于其带有的正电荷便于通过胞吞作用进入细胞,可以在近端肿瘤组织中高表达。缺点是脂质体本身代谢时间较快,很难表达在远端肿瘤细胞。裸质粒在安全性上更有优势,比如其免疫原性、毒性更低,不足之处则在于稳定性较差。
而病毒载体在基因治疗和细胞领域的应用更为广泛,大约有70%的治疗方案采用了病毒载体,其中包括各种逆转录病毒、腺病毒、腺相关病毒、疱疹病毒、痘病毒等。这些病毒载体有各自的特点,同时也存在各自的局限性。对于目前的基因/细胞治疗来说,慢病毒通常是首选的载体之一。尤其是在CAR-T治疗领域,慢病毒的应用非常普及,远远多于其他载体。
Q
目前的基因治疗如果要取得突破,需要解决的重要几个问题:如何优化出高效性、靶向性强的基因导入系统,如何增强外源基因表达的可控性,以及如何找到更多更好的治疗基因。
丹纳赫生命科学提供的解决方案
基因治疗与细胞治疗都需要面对资金需求大、全球化竞争、医保报销、药物不良反应等严峻挑战,为此需要药物开发者精心选择适宜的路线与技术,快速完成工艺的开发流程并获得审批,降低商品成本,最终获得可持续的利润。
个性化治疗的发展可能是一个漫长的过程,但它蕴含着未来的希望。丹纳赫生命科学具有完整的关于细胞培养、细胞工程和表征的解决方案,以帮助您快速完成由研发至生产的全部环节。
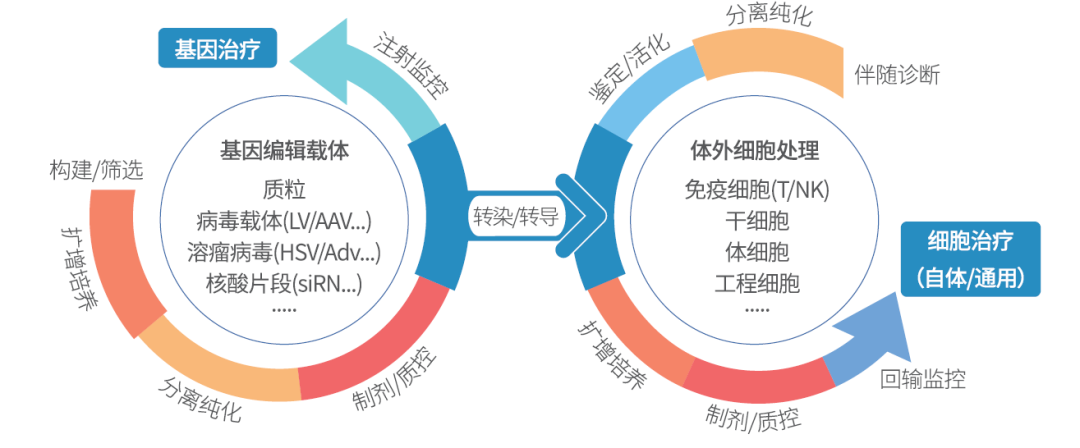
未来可期
今年,美国再生医学联盟(ARM)发布了2019年度报告。报告指出,全球用于再生医学临床试验的患者人数已达6万余人,并且预计,在未来的1-2年内被批准的基因疗法或细胞疗法的数量将再翻一番。这意味着越来越多患者开始了解并接受21世纪变革性、创新的疗法。
基因治疗及细胞治疗也是我国的重点发展战略,早在1991年,我国科学家就进行了世界上首例血友病B的基因治疗临床试验。2018年,国家知识产权局发布了新版《知识产权重点支持产业目录》,文件中明确将基因测序、免疫细胞治疗等党中央、国务院文件指出的重点发展方向列为重点支持产业。

为了使基因治疗和细胞治疗能够进入临床实验阶段,现阶段的首要任务是提高其安全性和精确度。新的基因编辑技术的应用,进一步改进表达载体和基因传递方式的设计方法等,都是实现目的的有效手段。
虽然基因治疗及细胞治疗尚未进入大规模临床应用阶段,但以上提及的研发方面取得的重大成就,将促进早期相关产品的增加。随着FDA批准的新的基因治疗和细胞治疗方法增加,越来越多的产品将走入普通人的生活之中。我们期待看到越来越多的基于基因治疗和细胞治疗手段针对多种类型的疾病、能够产生针对更多靶标的新产品。
欲了解更多丹纳赫生命科学的基因治疗与细胞治疗解决方案,欢迎参与我们9月期间在上海和广州举办的2020基因治疗和细胞治疗技术交流会,尽情关注我们的会议邀请。
报名参会
声明:版权为 SCIEX 所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权, 转载时须注明「来源:SCIEX」。申请授权转载请在该文章下“写留言"。

喜欢就点在看哟