
随着SARS-CoV-2 mRNA疫苗取得成功,人们对mRNA分子的研究兴趣激增,同时也对分析方法提出了新要求,以更好地支持新疗法的开发和生产。在关键质量属性(CQA)方面,例如全长mRNA的百分比、非翻译区(UTR)、3'' poly(A)尾长、mRNA序列、结构和化学修饰,是否存在正确的5''端帽结构对于确保最大的基因表达、逃避针对外来RNA的先天识别机制以及增加对核酸外切酶降解的抵抗力都至关重要[1]。

通过LC-MS分析确定5''端帽子的性质以及测量poly(A)尾巴的长度对于了解产品质量、确保mRNA新型疫苗的安全性和有效性十分关键[2]。沃特世科学家团队开发了⼀种快速、灵敏的LC-MS方法, 5分钟以内即可检测低至目标5''端加帽片段含量0.1%以下的产品相关杂质且拥有出色的线性。该平台方法结合高性能表面(HPS)技术改善mRNA片段分析性能的同时显著提高寡核苷酸回收率,快速实现 mRNA制剂的5''端加帽分析,简便易用、满足法规要求[3]。
疫苗中的mRNA通过酶促过程产生,即体外转录(IVT)。合成mRNA需要对其5’端进行修饰,形成5’端帽结构,3’端形成Poly(A)尾(长度通常约为120个核苷酸)。这些修饰是mRNA结构的关键特征,在细胞因子识别mRNA、合成mRNA的稳定性以及合成mRNA分子的翻译效率中发挥重要作用。其中,5’帽结构对mRNA稳定性和提高翻译效率起到很关键的作用。

图1. mRNA帽状结构
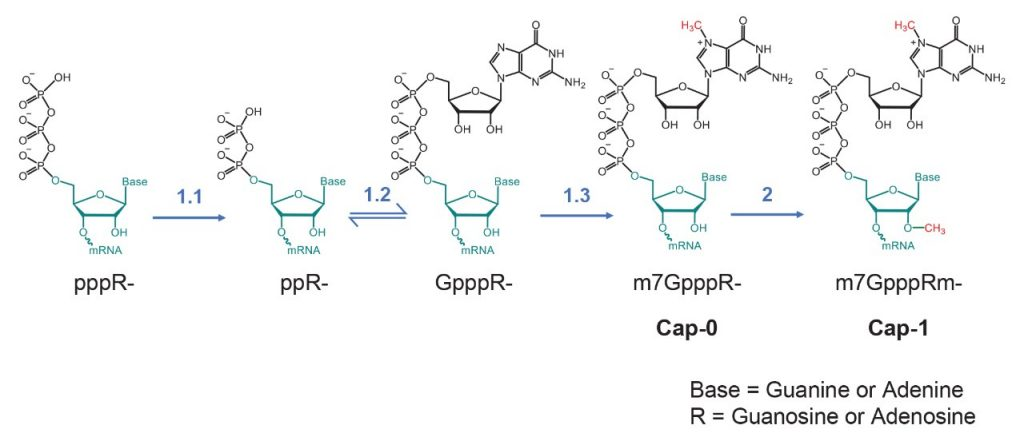
图2. mRNA的酶促加帽步骤
鉴于正确的帽状结构在mRNA翻译和先天免疫应答中发挥的重要作⽤,生产加帽RNA时必须确保有效性。如上图mRNA的酶促加帽过程所示,相对于Cap-1目标产物,其他产物可视为杂质,所以需要对Cap-1加帽率进行计算以监控合成反应及产品质量。mRNA的3’Poly(A)尾巴可以和5’端帽子结构共同协作,增强mRNA结构的稳定性, 所以在合成修饰过程中,需对Poly(A)尾巴分布进行监控。

图3. 液相色谱-质谱(LC-MS)联用方法。
针对mRNA疫苗5’端帽结构和3’Poly(A)尾巴的测定,沃特世应用科学家团队基于超高效液相色谱质谱联用系统BioAccord结合waters_connect软件,建立了一套简单便捷的流程化测定方法。通过waters_connect软件平台可进行方法编辑、数据采集及处理,实现5’加帽率和3’ Poly(A)加尾分布自动计算、自动匹配并生成相应报告模板,流程简便,且软件符合21 CFR Part 11法规要求,满足客户数据完整性需求,目前已被多家mRNA疫苗生产企业采用作为其研发与质控的有力工具。

图4. 合成mRNA 5''端的快速定量分析

图5. 自动计算加帽率

图6. 自动计算Poly(A)尾巴分布
(上下滑动查看更多)
已经证明寡核苷酸以及磷酸化化合物会吸附到不锈钢等金属表面,而采用MaxPeak Premier色谱柱可以缓解这种不必要的作⽤[4-6]。对于RNA 5''端帽状结构分析,使用传统的ACQUITY UPLC BEH C18寡核苷酸分析专用柱或装填同⼀批固定相的ACQUITY Premier BEH C18寡核苷酸分析专用柱研究了Cap-1(5''端包含m7GpppGm基团)的LC-UV-MS分离。已证实,配备MaxPeak⾼性能表面的ACQUITY Premier色谱柱具有更⾼回收率和开箱即用性能等优势,无需进行老化或钝化操作。

图7. 使⽤ACQUITY Premier BEH C18, 1.7 μm, 2.1 x 50 mm寡核苷酸分析专⽤柱第1次进样和使⽤ACQUITYUPLC BEH C18, 1.7 μm, 2.1 x 50 mm寡核苷酸分析专⽤柱第1次⾄第5次进样获得的Cap-1⽚段的UV⾊谱图
利⽤第1次进样的峰⾯积评估传统ACQUITY UPLC色谱柱与ACQUITY Premier色谱柱对Cap-1片段的回收率。传统色谱柱在初次使⽤时未观察到代表Cap-1物质的峰,而ACQUITY Premier色谱柱在第1次进样即出现高强度峰,并且在后续进样中得到可重现的峰⾯积。在传统色谱柱上,即使连续进样Cap-1后,到第5次进样时,Cap-1片段的峰⾯积仍仅为在ACQUITY Premier色谱柱所得峰面积的37%。
Cap-1 mRNA分子通过IVT生成,其百分比是⼀个重要的CQA,必须准确测定,以了解和预测合成mRNA制剂的有效性。在每个稀释水平下都可以清楚地观察到电荷态的同位素分布,且XIC取自整个同位素质量数,质量数偏差为10 ppm。即使在1:1000稀释水平下,此时产品相关杂质的柱上载样量仅12.5 fmol,Cap-0的XIC也很容易生成和积分。可以根据稀释系列的XIC⽣成校准曲线,各前体片段的校准曲线显示其线性回归得到的R平方值均为1.000,表明这种快速LC-MS方法足以用于评估5''端加帽程度。

图8. 采⽤DIPEA-HFIP流动相生成⾼质量MS谱图,Cap-1片段及其产物相关杂质片段(pppG、ppG、GpppG和m7GpppG, 或Cap-0)

图9. 使⽤ACQUITY Premier BEH C18, 1.7 μm, 2.1 x 50 mm寡核苷酸分析专⽤柱从Cap-0⽚段的[M-10H]10-电荷态获得的XIC

图10. 由12.5 pmol/μL Cap-1与其产品相关杂质⽚段(pppG、ppG、GpppG和m7GpppG或Cap-0)1:10、1:100和1:1000稀释系列生成的校准曲线。
(上下滑动查看更多)
在分析基于RNase H的mRNA片段时,⼀个重要的考虑因素是RNase H探针(或靶向寡核苷酸)与分析物之间的LC分离。在本例中,RNase H探针是⼀个3''脱硫生物素亲和标记修饰的RNA-DNA嵌合体,其长度与裂解的5''端片段大致相同。探针设计为⽬标5''端片段的补足物,使两者在溶液中杂交形成双链RNA-DNA双链体结构。在预定位点进行RNase H裂解后,探针和5''端片段在溶液中仍以双链体形式结合,因此,有必要从预计存在于样品混合物中的RNase H寡核苷酸探针上分离目标物质。

图11. 快速LC-MS⽅法可以在两种物质的等摩尔溶液中分离Cap-1 和代表性探针
可靠的分析方法对于确保疫苗的正确设计、开发和可重现生产而言至关重要。采用ACQUITY Premier BEH C18寡核苷酸分析专用柱结合BioAccord LC-MS系统的快速LC-MC方法,适用于评估合成mRNA的5''端加帽程度,这也是合成mRNA的⼀项重要CQA。
采用MaxPeak高性能表面技术的ACQUITY Premier色谱柱可以显著改善首次进样的RNA回收率。与BioAccord LC-MS结合使用时,即使在检测限较低的情况下也能准确定量,可用于验证Cap-1 mRNA分子的生产以及可能存在的产品前体相关杂质。
这些结果凸显了MS定量方法在高通量分析中的潜力,有助于加速mRNA疗法的开发。

如您想了解更多mRNA相关技术方案,欢迎在文末留言,我们将第一时间与您联系!
参考文献
1. Ramanathan, A.; Robb, G. B.; Chan, S. H. mRNA Capping: Biological Functions and Applications.
Nucleic Acids Research 2016, 44, 7511‒26.doi:10.1093/nar/gkw551.
2. Muttach, F.; Muthmann, N.; Rentmeister, A. Synthetic mRNA Capping.Beilstein J. Org. Chem. 2017,13, 2819‒32.doi:10.3762/bjoc.13.274.
3. Jennifer M. Nguyen Siu-Hong Chan Bijoyita Roy Martin Gilar Brett Robb Weibin Chen Matthew A. Lauber.Rapid Analysis of Synthetic mRNA Cap Structure Using Ion-Pairing RPLC with the BioAccord LC-MS System. Waters Application Notes.720007329EN.2021 August.
4. DeLoffi, M.; Nguyen, J. M.; Izzo, G. S.; Lauber, M.; Savaria, M. Premier C18肽分析专⽤柱与钛内衬C18⾊谱柱相⽐具有更⾼的⾊谱性能.沃特世应⽤简报, 720007022ZH, 2020
5. DeLano, M.; Walter, T. H.; Lauber, M. A.; Gilar, M.; Jung, M. C.; Nguyen, J. M.; et al.Using Hybrid
Organic-Inorganic Surface Technology to Mitigate Analyte Interactions with Metal Surfaces in
UHPLC.Anal.Chem.2021.doi:10.1021/acs.analchem.0c05203.
6. Gilar, M.; DeLano, M.; Gritti, F. Mitigation of Analyte Loss on Metal Surfaces in Liquid
Chromatography.J. Chromatogr., A 2021; 1650, 462247.doi:10.1016/j.chroma.2021.462247.
