
文章来源:生物药论 公众号
从首次将信使 RNA (mRNA) 递送到体内模型,到使用可电离脂质作为第一个批准的 siRNA 治疗药物的递送系统开发脂质纳米粒子,数十年的基础研究汇聚在一起,实现了mRNA疫苗及可行的治疗方法。鉴于在 COVID-19大流行期间在全球范围内取得的成功,mRNA 技术平台目前备受关注,不仅在疫苗方面,而且在癌症等多种疾病治疗方面都显示出巨大的潜力。作为一种具有广泛应用的药物,有可能彻底改变治疗领域。

mRNA技术依赖于将编码抗原或感兴趣的治疗蛋白的mRNA转移到细胞质中。这种遗传信息一旦被翻译,就会起到刺激免疫反应或改变疾病状态的作用。与 DNA 疗法相反,mRNA 不需要进入细胞核,因为表达直接发生在细胞质中。此外,这消除了与病毒载体和质粒 DNA 技术相关的基因插入风险。并且通过无细胞系统的制造消除了与传统基于病毒载体基因和细胞疗法相关的时间限制和可能的污染物。此外,新的 mRNA 产品意味着新的序列,但 mRNA 的理化特性保持不变,这意味着生产工艺的变化不大,从而形成强大的即插即用平台。该技术的多功能性使其具有广泛的治疗应用潜力,包括但不限于细胞重编程、基因编辑、蛋白质替代疗法和癌症免疫疗法。

从历史上看,基于RNA的基因和细胞疗法的进展一直受到与RNA不稳定性、对RNA分子的免疫原性反应以及RNA跨细胞膜递送相关的挑战的限制。然而,为了提高稳定性并减少 RNA 分子的降解,已经进行了一些改进,包括碱基修饰和脂质纳米颗粒 (LNP) 的出现,作为一种用于传递基于 RNA 的治疗的先进工具 。其中一系列药物已进入临床前和临床阶段,美国基因和细胞治疗协会(ASGCT)报告称,截至 2023 年 4 月,有 897 种 RNA 疗法处于临床研发阶段。此外,提及 mRNA 疗法的出版物数量在过去十年中一直在稳步增加,表明该领域的发展,如下图所示。
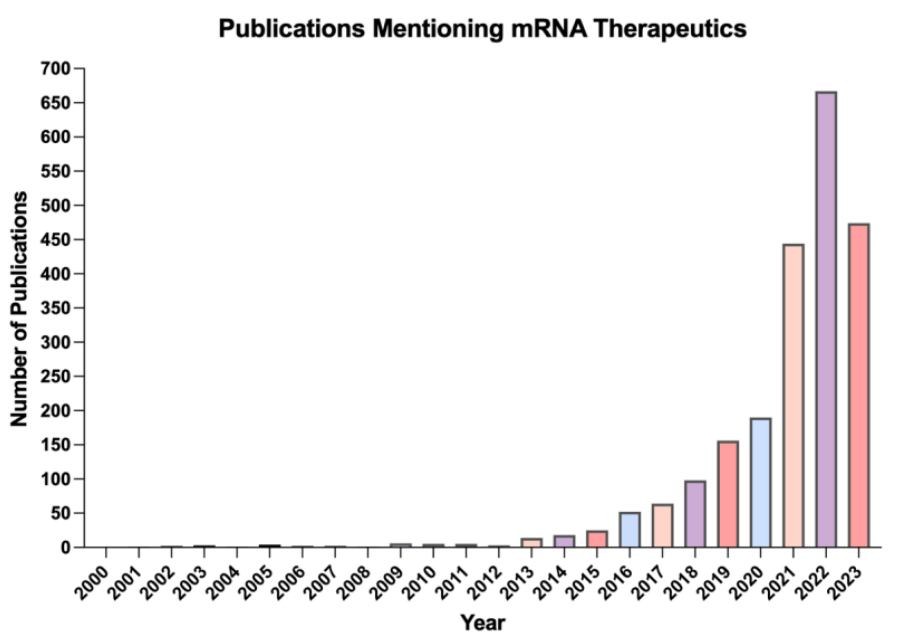
尽管该技术具有潜力,但 mRNA 疗法并未像疫苗那样迅速席卷市场,这主要是由于全球突发卫生事件期间监管流程不同。展望未来,与疫苗相比,mRNA 疗法将面临制造和监管方面不同的挑战。mRNA 疗法的应用、分类和生产方案的多样性使得简化监管审批变得更加困难。此外,在生产过程中必须严格控制dsRNA等免疫刺激副产物,以确保药物对长期mRNA治疗的免疫耐受性。
在临床应用中,普遍认为,mRNA原液的dsRNA含量应保持在0.5%以下。日前,西班牙 Certest Biotec公司团队发表题为“Purification of linearized template plasmid DNA decreases double-stranded RNA formation during IVT reaction”的研究论文,首次证实,提升线性化质粒模板的质量会显著降低IVT反应中的dsRNA含量。
目前,这些疗法在已发表的文献和专利范围内缺乏标准化的生产流程,并且制造受到与IVT所需的cGMP级试剂高成本的限制。重复给药的长期治疗需要具有稳定产量和质量,并且价格合适的药物。
在基因和细胞治疗的背景下,mRNA可用于替代或补充疾病基因和蛋白质。具体来说,mRNA 作为单基因疾病中基因或蛋白质恢复的工具是该领域感兴趣的。例如,Ramaswamy 等人进行的一项研究,证明了在小鼠模型中递送因子 IX 编码 mRNA 可治疗血友病 B 。同样,An 等人证明了使用编码人甲基丙二酰辅酶A变位酶的mRNA在小鼠中进行mRNA治疗可治疗小鼠的甲基丙二酸血症。还有Zangi 等人探索利用编码血管内皮生长因子 A 基因的 mRNA 进行心脏组织修复。
此外,mRNA在癌症治疗中的应用具有治疗价值。在这些情况下,mRNA 可用于传递自杀基因或肿瘤相关抗原 (TAA)。2019 年的一项研究检查了编码自杀基因的 mRNA 在结肠癌治疗中的用途,发现可以成功缩小小鼠模型中的肿瘤大小。近年来,几种针对罕见遗传疾病的 mRNA 疗法也已进入临床研发阶段,Moderna 和 Translate Bio 等公司在这一领域已率先布局。
由于mRNA可以快速制造,使得个性化基因疗法的发展前景充满希望。个性化医疗策略考虑每个患者的基因型特征,这将允许生产专门针对癌症患者、罕见代谢疾病患者和一系列其他病症的疗法。从制造角度来看,由于生产规模是针对个体患者而不是全球人口,这些个性化药物可能需要比在 COVID-19 大流行期间建立的生产设施更小。以医院为基础的 RNA 治疗计划,可以加快基因检测到小型 cGMP 级材料生产的过程,可以适应这些个性化治疗的实施。
mRNA疗法另一个活跃的开发领域是替代传统病毒载体建立的细胞疗法。具体而言,嵌合抗原受体(CAR)T 细胞疗法一直备受关注。该过程涉及使用 mRNA 将 CAR 递送至自体细胞,并在修饰后将这些细胞重新输注给患者。而在TCR-T细胞治疗领域,LionTCR(来恩生物)另辟蹊径,其电转mRNA表达构建HBV特异性TCR-T疗法已获FDA快速通道认可,临床结果显示疾病控制率为60%,缓解持续时间为27.7个月,患者的中位OS为33.1个月。此方法的其他多项临床试验,包括 ECI-006、MCY-M11和 Descartes-08,分别针对黑色素瘤、表达间皮素的实体瘤和多发性骨髓瘤。
同样,体外转录 mRNA 在基因编辑技术中的应用在文献报道和临床应用中都在增长。这项技术涉及编码基因组编辑核酸酶的 mRNA,包括ZFN、CRISPR 和TALEN,以及修复 DNA 突变的sgRNA。mRNA 在细胞质中表达编码的核酸酶,然后与sgRNA 一起进入细胞核。该技术避免了与 DNA 介导的方法相关的挑战,即在细胞质中表达和翻译之前将编码的核酸酶基因传递到细胞核。多项临床试验已经应用了这种技术,包括宾夕法尼亚大学赞助的一项治疗 HIV-1 感染患者的试验。Intellia Therapeutics 也已经开始了相关临床试验中评估这种疗法。

▲正在进行的临床试验按应用、递送方法和给药方法的分布
目前,有 84 项正在进行的(尚未招募、正在招募和活跃的)试验评估 mRNA 疗法,其中大多数针对癌症(如上图)。大多数正在进行的临床试验涉及使用脂质纳米颗粒或脂质体的 mRNA 疗法。在这些基于脂质的 mRNA 疗法中,涵盖多种治疗方法,包括蛋白质替代疗法、癌症免疫疗法、个性化癌症疫苗、mRNA 编码的单克隆抗体抗体和基因编辑(表 1),说明脂质纳米颗粒(LNP)技术具有多功能性。
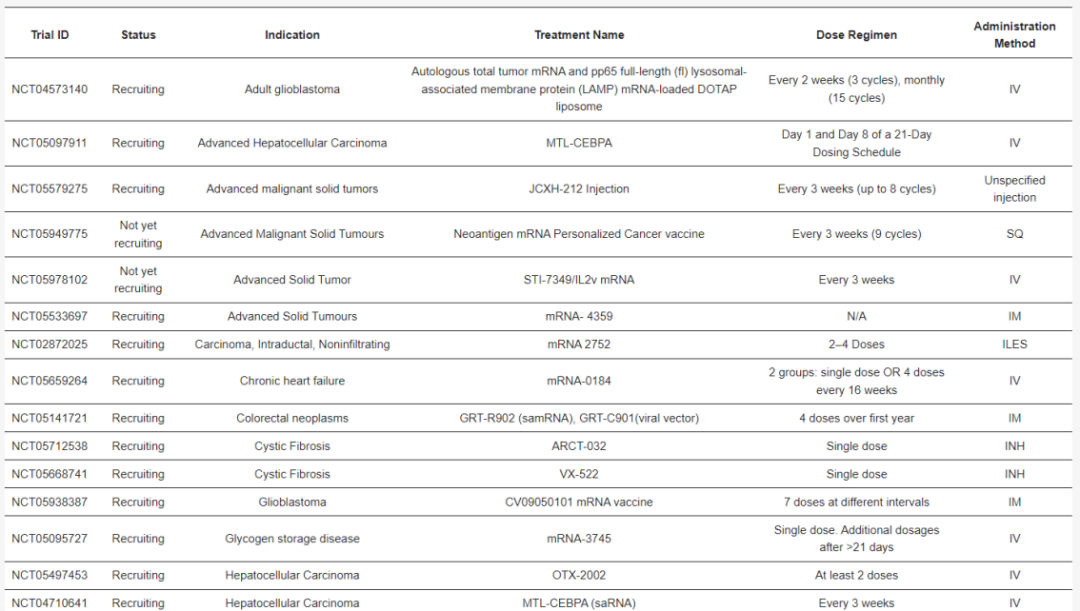
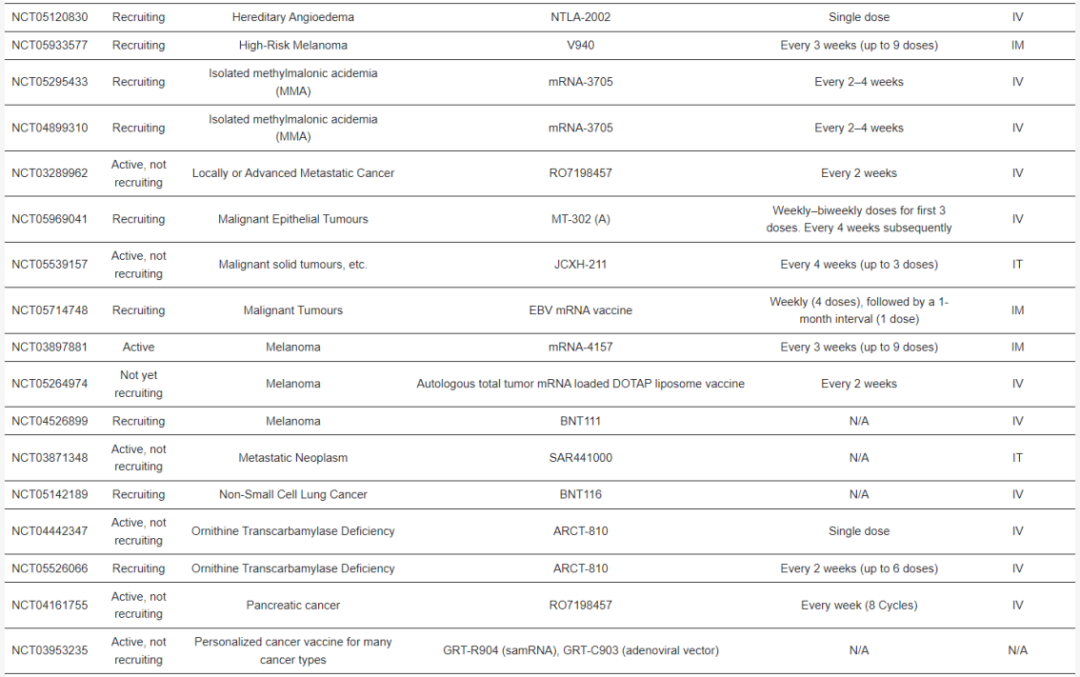

此外,当前正在进行的临床试验一致说明需要重复给药,强调了 mRNA 药物产品提高产量的生产工艺需要。然而,与病毒载体相比,mRNA 的安全性及其与蛋白质疗法相比在细胞内产生高水平蛋白质的能力平衡了 mRNA 疗法长期给药的挑战。
除了基于脂质的递送系统之外,目前正在进行的几项临床试验正在评估使用 mRNA 脉冲的树突状细胞用于癌症免疫治疗(NCT04963413,NCT04911621) , mRNA基于T细胞疗法(NCT05195294,NCT05302037),以及其他载体,包括外泌体和 VLP。而基于脂质的 mRNA 疗法的制造,在前期研究和临床领域普遍存在。相信随着临床的不断涌现,更多mRNA宽范围的应用产品会逐渐显现,普及跟多不同类型疾病的患者。

mRNA疗法的生产过程始于为后续IVT设计 DNA 模板。用于mRNA合成的转录模板可以是质粒DNA (pDNA)、PCR产物或合成双链寡核苷酸的形式。通常,DNA模板应包括以下元素:启动子序列、目的基因 (GOI)、5'' 和 3'' UTR、poly(A)尾。每个元件都可以进行相应的修改或选择,以提高 mRNA 的稳定性和翻译。
最常见的是T7启动子,序列 (5''-TAATACGACTCACTATA-3'') ,在 IVT期间被 T7 RNA 聚合酶识别,目前认为是用于mRNA生产制造的标准聚合酶。如果使用帽类似物 CleanCap AG,则在AGG启动子序列的 3''端需要一个额外的A 。如果使用不同的RNA聚合酶,例如T3或SP6,则DNA模板中必须存在相应的启动子。此外,在质粒DNA构建时,需要使用细菌选择的抗生素抗性标记序列和用于DNA模板线性化的限制位点,且需考虑该酶切位点是否具有GMP级核酸内切酶。
在目标基因编码治疗性蛋白的应用中,可以对编码序列进行优化以降低蛋白质免疫原性并增加蛋白质表达。例如,密码子优化可以使得翻译和半衰期增强。据报道,高GC含量会增加 mRNA 稳定性、核糖体关联,从而提高翻译效率。优化目的基因(GOI)中的GC含量,并在治疗性 mRNA 设计中同时去除尿苷,不仅可以提高延伸率和翻译效率,还可以改变 RNA 二级结构,从而干扰基因表达。
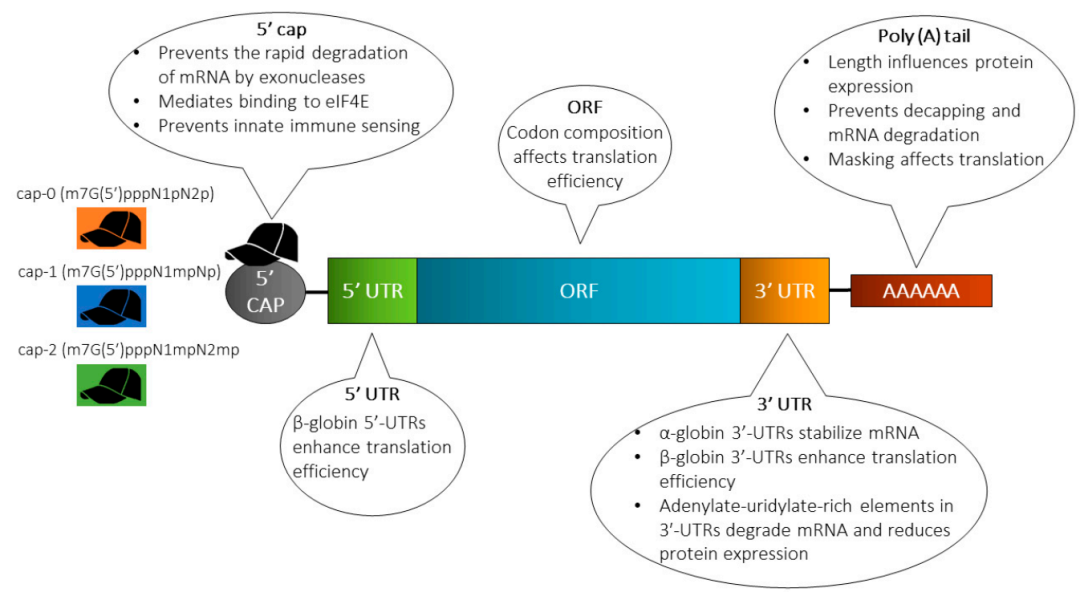
5''和3''UTR对于所递送的治疗性 mRNA 分子的稳定性和翻译起始都是不可或缺的,其中β-globin UTR 已广泛应用于临床试验和研究领域。5''UTR的长度、序列元件和二级结构,在翻译起始中发挥着重要作用,哺乳动物体内5''UTR 的平均长度范围为约100至200nt。然而,有人提出,20nt左右的较短 5''UTR可最大限度地减少翻译起始过程,从而最大限度地提高蛋白质表达。此外,应避免5''端附近的高度稳定的二级结构,其会破坏核糖体结合和起始翻译。根据治疗目的,可以通过向 5''UTR 引入额外的序列元件来实现选择性翻译。在癌症治疗的背景下,肿瘤内注射mRNA可能需要能够在低营养限制下翻译的特殊5''UTR 元件。
3''UTR与5''UTR 类似,包含影响翻译效率和 mRNA 稳定性的调控元件。人们普遍认为,较短的 3''-UTR 由于 microRNA 结合位点的丢失而增加了mRNA的稳定性,从而避免了mRNA的降解。此外,使用两个连续的β-globin 3''UTR可显著提高蛋白质表达水平并延长蛋白质的持久性。可利用高通量技术针对UTR优化和开发,包括新颖的基于细胞的选择过程,用于识别可增加合成mRNA编码的蛋白质表达的UTR,以及用于优化的大规模并行功能分析。


Poly(A)尾在mRNA翻译和稳定性中起着关键作用,可以保护mRNA免受核酸酶降解。可以通过在转录后使用 Poly(A) 聚合酶或 在DNA 模板中带有Poly(A) 序列将 Poly(A) 尾添加到 mRNA 中。后者是临床应用的标准做法,一致性较高。将 Poly(A)尾延伸至120 nt 可提高翻译效率,这说明长度是需要考虑的一个重要方面。此外,Trepotec 等人。证明了使用分段聚(A)尾的好处,带有6个或单个核苷酸(G/T)间隔120nt的分段Poly(A) 可以避免了细菌复制过程中质粒DNA的重组,而不会损害蛋白质表达和 mRNA 半衰期(如上图所示)。
为了在 IVT 中使用,需要线性化和纯化的 DNA 模板。尽管有多种制造模板DNA的方法,但目前主流还是使用细菌发酵来获得质粒DNA。另外还有合成和酶促方法来制造这些模板,包括 PCR。
质粒DNA的产生通常通过大肠杆菌( E.coli )的发酵来进行。已报道了几种不同的 pDNA 菌株,例如 DH5α、DH5、DH10B、DH1、JM108和SCS1-L。其中,由于先前已建立的有效生产放大工艺及临床应用,DH5α仍然是实验室和工业实践中使用的标准菌株。在工业规模上,细菌培养扩增主要遵循三个步骤:接种细菌、摇瓶发酵和大规模生物反应器发酵。为了使用该生产平台提高 pDNA 产量,可以选择高产菌株和结合不同的培养基成分和培养策略(例如分批或补料分批模式)。

载体工程也有助于提高产量,如使用基于pUC的质粒和基于R1的质粒。有研究证明与分批模式培养相比,补料分批模式培养可产生更高的质粒体积产量。常见pDNA的产量为100–250 mg/L,而使用标准高拷贝pUC起始质粒和新型控制参数进行补料分批发酵可提高pDNA产量(高达 1500 mg/L)。其中,补料分批模式下发酵DH5α,在分批阶段以葡萄糖和甘油作为初始碳源,与类似补料阶段但不添加甘油的情况相比,产量翻倍。事实上,甘油因其可以提高pDNA产量,被认为是葡萄糖的补充碳源。最常用的大肠杆菌培养基是以酵母提取物作为氮源的Luria Broth (LB),另外还有改良的MBL培养基。
为了避免通过细菌发酵生产pDNA所涉及的克隆和制备步骤,这些步骤既昂贵又耗时,一些工业生产平台已经采用了替代的模板生产方法。发酵过程可能需要几天,有时甚至几周,并且涉及昂贵的试剂,包括细菌和抗生素。最终产品中生物污染的相关风险也已成为临床GMP中不可避免的问题。
因此,PCR等合成DNA平台得以应用,来生产mRNA合成所需的DNA模板,这种基于合成寡核苷酸PCR生产DNA模板的方法,在短短几个小时之内可扩增至微克级别,使DNA生产到mRNA合成可以快速完成,此类方法应用于用量很小的mRNA疗法再合适不过,比如个性化mRNA肿瘤疫苗的产生。

此外,还有其他合成DNA生产方法,如上图,Touchlight Genetics公司使用体外双酶工艺开发了一个合成DNA制造平台。这种专有的酶平台可在数周内生产出数克DNA,从而实现快速、大规模生产。然而,尽管合成 DNA 模板生产具有潜力,但这些方法尚不能合成更长的DNA链。不仅要考虑产量,还要考虑错误率,应避免序列中的突变,这一点至关重要。为了生产用于治疗应用的mRNA,DNA模板有时需要几千个碱基长,因此细菌发酵目前仍然最适合的生产方法,预计短时间内很难被取代。
为了用于后续IVT反应,DNA模板必须进行纯化和线性化,以确保随后产生的mRNA的质量。在细菌发酵的情况下,纯化过程最关键且最复杂。从细菌细胞中纯化pDNA通常从收获后的碱裂解步骤开始,其中使用十二烷基硫酸钠(SDS)和NaOH等溶液最常见。接下来,在澄清之前中和裂解物。然而,由于所得沉淀物的粘性,其成分的分离只能通过预过滤或离心,然后进行澄清过滤,这个过程既耗时又昂贵。此外,由于DNA对剪切应力的敏感性,还需要以低剪切应力技术来温和地混合细菌裂解物和中和剂,例如 PlasmidFactory 的专利中描述的基于浮选的方法。另外一种 pDNA 纯化方法是煮沸裂解,该方法已通过连续热裂解提取质粒DNA的简化方法成功大规模使用。
 ▲图片源自网络
▲图片源自网络在许多传统的质粒DNA纯化过程中,首先使用RNAse酶降解RNA,然后再进行pDNA层析分离步骤。然而,RNAse A是从牛胰脏中纯化出来的,其外源性在大规模生产中受到关注。因此,应尽量避免添加RNAse。
为此,提出了无RNAse的纯化方法,使用氯化钙沉淀,然后进行切向流过滤(TFF),分别去除高分子量 RNA 和低分子量 RNA。这两个步骤也有助于减少微生物蛋白质和宿主DNA,并且可以浓缩产物。此外,在色谱分析之前进行浓缩可以减少柱上样时间,从而加速整个过程。
纯化过程中,基于不同原理的层析步骤可分离不含宿主DNA、RNA、蛋白质和内毒素的高纯度质粒,包括分子排阻层析、亲和层析、离子交换层析和疏水层析。质粒可以以多种亚型收集:超螺旋圆形亚型、开放圆形和线性,超螺旋是其中最稳定的类型,不同的层析方法组合可以优化整个纯化工艺,得到高纯度的超螺旋pDNA。
DNA 模板必须线性化,为mRNA转录做好准备。在IVT反应中,对于SP6 和 T7 RNA 聚合酶, 5'' 悬垂(overhang)更适合确保聚合酶的稳定性并增强转录效率。为了在线性化后实现这种5’悬垂,可以使用核酸内切酶,例如 HindIII、SpeI、SapI、NotI、EcoRI等 。
线性化的DNA模板需要去除酶以及非线性化的 DNA,从而分离纯化得到线性化DNA模板用于IVT反应。在实验室和工业规模的生产中,苯酚氯仿萃取已成为该步骤的标准技术。然而,由于苯酚和氯仿存在一定危险性,已不再是大规模临床操作的首选。因此,使用带正电荷的树脂进行强阴离子交换色谱的方法由然而生,该方法得到的mRNA质量与苯酚氯仿提取相当。随后利用TFF去除较小的杂质,同时将DNA模板置换到适当的溶剂中进行后续的IVT mRNA生产。
mRNA通过IVT产生,模拟体内转录过程,是一个相对快速且简单的过程,其中RNA聚合酶消耗 NTP来催化从相应的DNA线性模板合成mRNA。所需的成分包括RNA聚合酶、NTP、镁 (MgCl 2) 和反应缓冲液。常见使用各种噬菌体聚合酶,例如 T7、T3 或 SP6 RNA聚合酶。T7 RNA聚合酶(T7 RNAP)是研究和生产中最常用的RNAP,因其能够高保真的生成全长RNA转录本(超过 20 kb)。

尽管T7 RNAP 对非天然 NTP 的掺入具有高保真度和耐受性,但它也会产生免疫刺激副产物,例如dsRNA,这可能会影响蛋白质表达并使下游纯化过程变得更加困难。dsRNA分子是先天免疫反应激活剂,因此在治疗应用中应避免其产生,这是因为临床治疗当中的免疫耐受性极为重要。
可以通过使用计算、结构和实验室筛选方法设计突变型T7 RNAP,减少dsRNA 副产物的产生。例如,双突变 T7 RNAP (G47A + 884G)成功降低了dsRNA含量,同时保持了RNA产量和纯度。其他包括热稳定性RNA聚合酶的开发,例如 BioLabs 的 Hi-T7 RNA聚合酶M0658,该酶经过工程设计,可以承受高温下进行的IVT,防止环回转录。然而,一些专家指出,高温(≥48°C)难以扩大规模,并可能导致RNA降解。
另外,在IVT 期间添加浓度为1 M的尿素被证明是减少导致 dsRNA 形成的不需要的核碱基配对的有效方法。此外,在上一期内容中我们也提到,提高DNA模板的质量也可降低dsRNA的产生。
镁离子是 T7 聚合酶的辅助因子,而当游离Mg 2+低于5 mM时,转录率和IVT效率均大大降低,目前对于游离Mg 2+浓度的理想条件缺乏共识。Sartorius等人研究声称每个反应 12–20 mM MgCl 2会增加 mRNA 产量,但 Young 等人声称游离 Mg 2+的理想范围为 50 至 60 mM 。乙酸镁和氯化镁均可用于IVT反应。有研究表明,在IVT中时,醋酸镁优于氯化镁,并且得到证实。
2023年诺贝尔医学奖颁给了匈牙利科学家卡塔林·卡里科(Katalin Karikó)和美国科学家德鲁·韦斯曼(Drew Weissman),因为他们两位发现了使用修饰的NTP(例如 N1-甲基假尿苷 (m1ψ))可以降低合成mRNA的免疫原性并驱动高水平的蛋白质产生,这归因于减弱了 TLR3 激活的能力。其他修饰核苷酸的掺入,如假尿苷 (ψ)、5-甲基胞苷 (m5C)、N6-甲基腺苷 (m6A)、5-甲基尿苷 (m5U) 或 2-硫尿苷 (s2U) 也使得免疫刺激作用降低。减少免疫刺激和增加mRNA分子的稳定性在mRNA治疗和蛋白质替代治疗中尤为重要。
有人提出向反应混合物中添加亚精胺可以增强转录,而较高浓度下又具有抑制作用。随后通过实验设计 (DoE),发现亚精胺在浓度为0.2至 2 mM时可增强转录,进一步支持其用途。

成熟的mRNA需要5''Cap结构来保证mRNA稳定性和基因表达。Cap 1(m 7 GpppN 1 mp) 结构是实现最佳mRNA稳定性和表达的首选结构,因为它被免疫系统识别为自身结构。另一方面,Cap 0(m 7 GpppNp) 可以激活先天免疫反应,损害稳定性和表达水平。有两种主要的加帽方法:(i) 转录后单独加帽 (ii) 共转录加帽,仅一步过程,将 Cap 类似物掺入IVT反应当中。
痘苗病毒加帽酶 (VCE) 通常用于酶加帽并产生 Cap 0结构,使用2''-O-甲基转移酶(2''-O-MTase)的附加步骤将Cap 0修饰为Cap 1结构,高达100%的加帽效率。Moderna在其针对SARS-CoV-2的mRNA-1273 疫苗中采用了这种后加帽策略。然而,值得注意的是,添加几个酶促步骤,包括步骤之间增加的纯化和缓冲液交换,会使该过程变得复杂且难以把控。
共转录加帽可以减少生产步骤,然而Cap类似物的早期迭代存在mRNA反向延伸的风险,从而降低翻译效率。为了避免这种情况,出现了抗反向帽类似物(ARCA)。然而,它只能用于生成具有Cap 0结构和较低的加帽效率 (60–80%)。后来,Clean Cap 帽类似物的出现彻底改变了该领域,因为这种帽类似物可以高效的共转录添加天然存在的Cap 1结构(90-99%),Pfizer -BioNTech的BNT162b2疫苗中就使用了这种帽类似物。与酶法加帽相比,加帽类似物可以更简单、更快速的生产,但由于专利授权问题可能会带来很高的成本,得失之间,应分析考量其中的利差关系。
IVT反应可以以分批和补料分批模式进行。补料分批需要在反应过程中添加NTP和Mg 2+,这些组分对反应速率和产率影响最大。补料分批IVT已应用于较大的mRNA分子,可以提高产量。NTP的消耗可以在整个反应过程中使用HPLC进行监测,并相应地补充。极低和极高的NTP浓度都会限制 mRNA 的生产,因此需要研究在整个生产过程中控制NTP水平的方法。通常分批生产的产量为5 g/L,而补料分批可以实现mRNA产量高达12 g/L,这说明此类工艺研究有非同寻常的潜力。
尽管以连续模式生产mRNA疗法尚未实现,但有人已经探讨了这一观点。通过连续的方式整合生产和纯化来优化mRNA制造,可以减少过程中的保存时间和冻融周期,从而有可能提高最终产品的质量和产量。这可以解决大量低免疫原性mRNA制剂重复给药的需求。自扩增RNA (saRNA)可以以较低的剂量即可达到与传统mRNA相同的蛋白质表达水平,是一种减少制造和成本负担的方式。而saRNA 可能存在免疫原性,使其不适合长期给药的治疗。
连续流程需要在整个生产过程中严格把控,验证产品质量并促进其自动化。明确的流程模型对于向连续自动化生产的过渡至关重要。为此,有学者建立了在塞流和连续搅拌反应器中连续生产mRNA的计算机模型,并确定与连续搅拌反应器中的批量生产相比之前,产率的理论改进系数为56倍。还建议使用控制回路,例如比例积分微分(PID)控制,可能是提高生产率、稳健性和遵守关键质量属性(CQA)的关键。未来,在mRNA疗法的连续端到端制造中进行数字设计和概念设计,为未来的实验工作建立初始框架,以建立在这些初始方法的基础上。
化学合成方法最初由 Merrifield 于 1963 年建立,用于生产肽,随后化学合成方法适用于短寡核苷酸的生产,并由 Beaucage 和 Caruthers 改进。一旦扩大到工业规模,这种方法就可以生产公斤级的寡核苷酸,并且可以完全自动化。该方法依赖于亚磷酰胺化学,涉及在固体支持物上以序列特异性方式循环添加核苷。
然而,这种 RNA 生产方法仅适用于短寡聚物,目前使用这种方法最多可能延伸约100-150 nt。这使得该方法目前不适合mRNA生产,但它适合生产siRNA、miRNA 和反义寡核苷酸 (ASO) 分子。通过合成两条单独的链并通过连接酶(即 T4 连接酶)将它们连接在一起,可以形成更长的RNA分子,但这尚未达到mRNA 酶促合成的效率和生产力。
三、mRNA生产下游工艺
在mRNA制剂生产步骤,除了上一期我们介绍的DNA模板以及体外转录部分外,下游mRNA纯化,递送及制备也同样非常重要。在IVT生产出来之后,需要进行层层纯化去除其中的杂质,这有助于确保最终mRNA制剂的纯度及安全性。得到纯度较高的mRNA后,还需要将其封装成制剂产品,用于临床应用。这需要考虑封装制剂的形式,因为其对于最终mRNA能否成功体内递送并转录发挥疗效非常关键。
01
mRNA纯化


 ▲CaptoCore树脂结构
▲CaptoCore树脂结构02
mRNA递送
 ▲mRNA-LNP制剂组成结构
▲mRNA-LNP制剂组成结构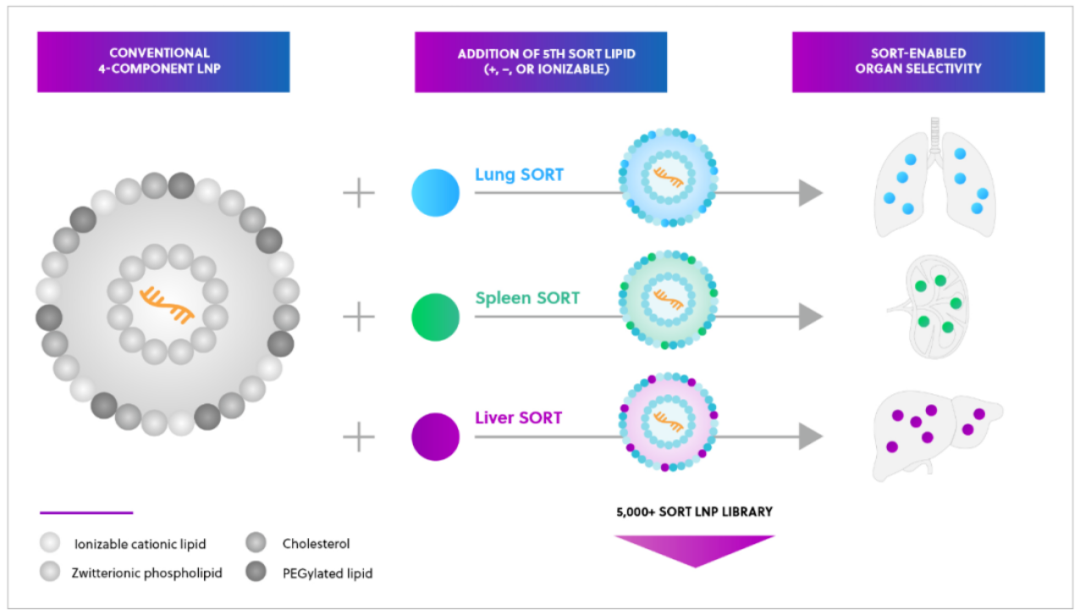 ▲ SORT-LNP技术平台(ReCode Therapeutics官网)
▲ SORT-LNP技术平台(ReCode Therapeutics官网)03
mRNA-LNP合成


04
mRNA-LNP 制剂及优化

结语
6.Touchlight Genetics官网
7.Mauger, D.M.; Cabral, B.J.; Presnyak, V.; Su, S.V.; Reid, D.W.; Goodman, B.; Link, K.; Khatwani, N.; Reynders, J.; Moore, M.J. mRNA structure regulates protein expression through changes in functional half-life. Proc. Natl. Acad. Sci. USA 2019, 116, 24075–24083.
8.TriLink Biotechnologies. CleanCap Reagent AG Product Insert (Catalog No. N-7113 Version v3).
9.Holtkamp, S.; Kreiter, S.; Selmi, A.; Simon, P.; Koslowski, M.; Huber, C.; Tureci, O.z.; Sahin, U. Modification of antigen-encoding RNA increases stability, translational efficacy, and T-cell stimulatory capacity of dendritic cells. Blood 2006, 108, 4009–4017.
10.Trepotec, Z.; Geiger, J.; Plank, C.; Aneja, M.K.; Rudolph, C. Segmented poly(A) tails significantly reduce recombination of plasmid DNA without affecting mRNA translation efficiency or half-life. RNA 2019, 25, 507–518.
11.Kowalski, P.S.; Rudra, A.; Miao, L.; Anderson, D.G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Mol. Ther. 2019, 27, 710–728.
12.Cui, T.; Fakhfakh, K.; Turney, H.; Güler-Gane, G.; Toloczko, A.; Hulley, M.; Turner, R. Comprehensive studies on building a scalable downstream process for mRNAs to enable mRNA therapeutics. Biotechnol. Prog. 2023, 39, e3301.
13.U.S. Patent US20210214388A1
14.Baiersdörfer, M.; Boros, G.; Muramatsu, H.; Mahiny, A.; Vlatkovic, I.; Sahin, U.; Karikó, K. A facile method for the removal of dsRNA contaminant from in vitro-transcribed mRNA. Mol. Ther.-Nucleic Acids 2019, 15, 26–35.
15.Hassett, K.J.; Higgins, J.; Woods, A.; Levy, B.; Xia, Y.; Hsiao, C.J.; Acosta, E.; Almarsson, Ö.; Moore, M.J.; Brito, L.A. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. J. Control. Release 2021, 335, 237–246.
16.Henderson, M.I.; Eygeris, Y.; Jozic, A.; Herrera, M.; Sahay, G. Leveraging biological buffers for efficient messenger RNA delivery via lipid nanoparticles. Mol. Pharm. 2022, 19, 4275–4285.
17.U.S. Patent US20200069599A1
18.Zhao, P.; Hou, X.; Yan, J.; Du, S.; Xue, Y.; Li, W.; Xiang, G.; Dong, Y. Long-term storage of lipid-like nanoparticles for mRNA delivery. Bioact. Mater. 2020, 5, 358–363.
19.Lamoot, A.; Lammens, J.; De Lombaerde, E.; Zhong, Z.; Gontsarik, M.; Chen, Y.; De Beer, T.R.; De Geest, B.G. Successful batch and continuous lyophilization of mRNA LNP formulations depend on cryoprotectants and ionizable lipids. Biomater. Sci. 2023, 11, 4327–4334.