蛋白质组学是生命科学领域重要的研究手段,在基础研究、转化研究领域中都有广泛的应用,但是目前蛋白质组学仍然存在诸多挑战。由于蛋白质丰度差异极大,低丰度蛋白质的研究对于仪器的灵敏度提出了很高要求;在临床转化研究方面,常规蛋白质组分析通量低、定量能力不足,在进行大规模样本分析时极具挑战;此外,蛋白质组复杂程度极高,蛋白质可能同时存在多种翻译后修饰(PTM),而常规的碰撞诱导解离技术对于翻译后修饰的鉴定和定量存在很大局限性。
面对这些问题,SCIEX ZenoTOF™ 7600系统可以提供“更快、更高、更强”的解决方案。ZenoTOF™ 7600系统的电子活化解离(EAD)技术可以提供丰富的修饰碎片信息,同时不造成中性丢失,并且EAD能量可调,可针对特定的PTM进行能量优化。此外,ZenoTOF™ 7600系统采用新颖的捕获/释放技术Zeno™ Trap(Zeno阱),可以提供超过90%占空比循环,将灵敏度提升至4-20倍。这些提升并没有牺牲其他系统性能,7600系统仍然可以提供高扫描速度和高分辨率,在高通量研究中具有独特优势。

高通量蛋白质组分析
速度“更快”!鉴定数量“更高”!
灵敏度(尤其是MS/MS灵敏度)是蛋白质组学实验的关键性能指标,高灵敏度的MS/MS为蛋白质鉴定(ID)提供了广泛而深入的覆盖。ZenoTOF 7600系统使用Zeno trap技术,在整个碎片离子质量范围内增加占空比≥90%,在MS/MS模式下获得4-25倍的增益3,这些提升可以在蛋白质组学发现研究中提供出色的表现。
在分别激活和不激活Zeno 阱的情况下,上样400 ng K562细胞裂解液进行10分钟液相梯度的MS/MS信号采集。粉色曲线为开启Zeno阱的MS/MS总离子色谱图,蓝色曲线为关闭Zeno阱的MS/MS总离子色谱图(图1)。当使用Zeno阱时,TIC高度显著增加。此外,MS/MS的谱图质量也大大提高。

图1. 在Zeno 阱激活和未激活时400 ng K562 细胞裂解液在10 min液相梯度中采集的数据对比。
通量也是蛋白质组学研究中非常重要的因素,ZenoTOF 7600系统配备微升流速液相体系,在短梯度内也能达到较高的肽段鉴定数量,并且开启Zeno阱的功能有助于提高肽段鉴定。在上样200 ng K562细胞裂解液时,对比Zeno 阱开关时肽段鉴定数量,可以看到,在所有梯度内,Zeno阱的激活都有助于鉴定数量的提升,在20 min以上的有效梯度中,Zeno阱的激活可以使肽段鉴定数量增加超过55%(图2)。
图2. 激活Zeno阱后肽段鉴定数量增加。在global FDR 为1%时,200 ng K562细胞裂解液在不同梯度中的肽段鉴定数量。Zeno阱大大增加了所有梯度中的肽段鉴定数量。
Zeno阱的应用对于蛋白质和肽段数量的鉴定都有很大程度的提高,通过对比ZenoTOF 7600系统与TripleTOF™ 6600系统,无论在短梯度和长梯度中,相同进样量时7600系统鉴定到的蛋白数量和肽段数量都超过6600系统。
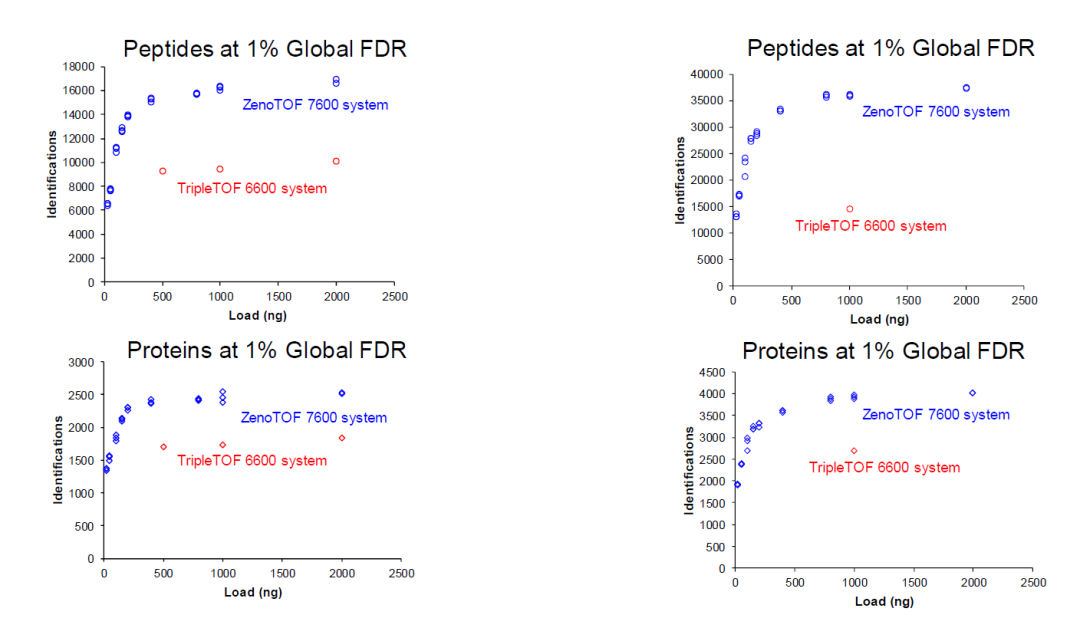
图3. 在10min (左侧)和45min (右侧)梯度中ZenoTOF 7600系统与TripleTOF 6600系统鉴定到肽段和蛋白质数量对比。与TripleTOF 6600系统(红色)相比,ZenoTOF 7600系统(蓝色)鉴定出更多的肽段和蛋白质。
大规模蛋白质和多肽定量分析
灵敏度“更高”!速度“更快”!

ZenoTOF 7600系统具有较高的分辨率、更高的选择性、TOF MS/MS数据的灵活性,还可提供出色的多维度定量性能。使用Zeno MS/MS,质荷比300以上的肽段离子的理论灵敏度提高了4-6倍3。采用Zeno trap关闭与Zeno trap打开的最终测定方法对804个肽段进行了对比实验,并评价了MS/MS灵敏度(图4)。所监测肽段的灵敏度符合预期,平均峰面积提高约5倍。
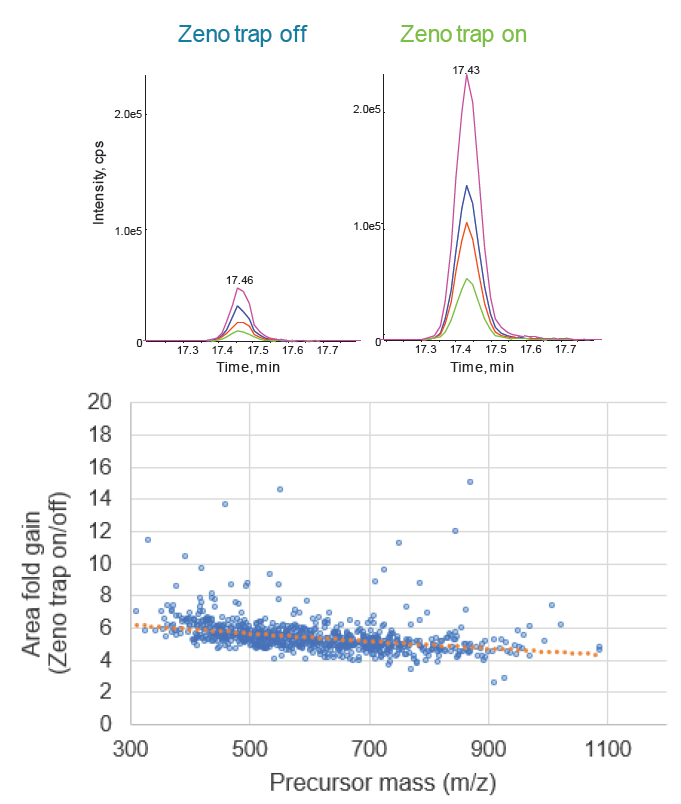
图4. 激活Zeno trap后多肽峰面积显著增加。(上图)显示了ANT3.PFLVFIR 激活Zeno trap时观察到的灵敏度提高的示例数据,峰面积提高约6 倍。(下图)汇总展示了所有 804 种肽检测到的灵敏度数据,通过前体离子m/z提取数据,平均提高为 5.6倍。
为了使用仅20分钟的快速梯度执行如此高度多重的分析,必须具有高度可重现的色谱和良好的峰形,以便可以使用非常窄的预定时间窗口(图5)。在捕集-洗脱模式下,整个梯度的保留时间标准偏差大多小于2秒。建立了最终的 804 种肽Scheduled MRMHR检测方法后,同时评估了肽段定量的重现性。10 次重复进样中,804 种肽段在加入酶解的人血浆基质后的每种肽的中值%CV为 6.1%,表明这种 804 种重标肽的高度多重分析具有极高的重现性,97.9% 的多肽的 %CV 小于 20% (图6)。

图5. 10 次血浆样品重复的色谱峰重现性。(上图)在整个方法开发和最终数据生成过程中都检测到了非常好的色谱重现性,804 种肽段和所有 10次重复的平均%RSD 为 0.23。(下图)运行中检测到的保留时间标准偏差与检测到的保留时间图,显示大多数峰在 10 次重复中的偏移小于几秒。
图6. 靶向肽定量的高重现性。将PQ500肽(柱上 40 fmol)注射到血浆中(柱上 500 ng)重复进样 10 次,测定肽峰面积的重现性。圆点的大小和颜色表示重现性图中该点的肽段数量较多,如顶部的图例所示。中值 CV 为6.1%,而97.9% 的肽段的 CV 小于 20%,突出了该测定的非常好的重现性。
采用Zeno MRMHR方法在所检测的浓度范围内观察到非常好的线性。当多肽离子强度低于Zeno trap阈值时,会激活Zeno trap。来自PEDF的肽ELLDTVTAPQK,在柱上检测到的定量下限(LLOQ)为 82.2 amol,CV 为 19.2%,准确度为 90.2%(图7)。

图7. PEDF.ELLDTVTAPQK 的浓度曲线。ELLDTVTAPQK 在 500 ng血浆中的浓度曲线显示出良好的重现性和线性,从柱上 82.2 amol到柱上 19.9 fmol的最高测量点(r2= 0.995)。定量下限 (LLOQ) 的肽信号(4个碎片离子的总和)显示在右下方,具有良好的信噪比,并通过了LLOQ 的生物分析标准。空白进样的信号在左下角,曲线的统计数据显示在顶部的表格中。
翻译后修饰分析
EAD技术“更强”!

翻译后修饰(PTM)在多种生物学过程中扮演重要角色,包括蛋白质构象和信号转导等等。赖氨酸酰化,例如丙二酰化,是一种部分受Sirtuin(SIRT)蛋白质家族的成员赖氨酸脱酰酶调节的PTM。在之前一项关于SIRT5调节的赖氨酸丙二酰组的研究中发现,在1137个丙二酰赖氨酸鉴定位点(来自430个蛋白质)中,183个位点(来自120个蛋白质)在SIRT5 - / - KO 小鼠中比野生型小鼠中显著增加1。具体来说,丙二酰化可调节GAPDH的活性,因此丙二酰化的鉴定对于研究代谢相关通路具有重要意义。然而,丙二酰化肽段通常很难通过质谱和CID来表征,因为这种修饰极其不稳定。
ZenoTOF 7600系统具备灵活的多重碎裂能力:碰撞诱导解离(CID)和电子活性解离(EAD),通过观察来自GAPDH(TVDGPSGKmaLWR,K-192)中的丙酰基位点在两种正交的碎裂模式(EAD与CID)中的碎片,可以看到使用CID碎裂模式,y离子系列碎片中活性丙二酰基团中CO2显著的中性丢失(-44 m/z)(图8A),然而EAD碎裂模式可生成完整的z+1离子和c离子系列碎片,在MS/MS图谱中很容易检测到(图8B)2。具体来说,从z4+1到z11+1,或者包含不稳定PTM的c9和c10等碎片离子,都没有发生显著的中性丢失,这使得PTM位点得以明确定位。

图8. TVDGPSGKmaLWR肽段在CID和EAD模式下的MS/MS谱图。丙二酰化肽段 (m/z656.3320) 分别采用(A) CID模式和(B) EAD模式(KE=5 eV)进行分析。CID碎裂会导致-CO2(-44)的中性丢失,无法检测到“完整的”PTM特异性区分性离子。全面的EAD解离产生了高强度的碎片离子,为直接的PTM位点定位提供了证据。
利用ZenoTOF 7600系统上 EAD 的动能(KE)可调节特性,可确定保留PTM修饰肽段上不稳定修饰的适合解离参数,同时实现更佳的灵敏度。KE值为5 eV时,可产生高强度、完整的 PTM 位点特异性碎片离子,同时背景噪声很小。当KE增加到8 eV或更高时,MS/MS谱图变得更加复杂,含有PTM修饰的碎片离子的中性丢失出现(图9)。

图9. EAD动能 (KE) 值对碎裂模式的影响。 在EAD模式下分析丙二酰化肽段TVDGPSGKMALWR (m/z 656.330) 的MS / MS图谱,其动能值分别为(A) 5 eV和(B) 8 eV。
7600系统中Zeno阱的应用大幅度提升了MS/MS图谱质量和灵敏度。在激活Zeno阱和未激活Zeno阱的情况下分别采集的EAD MS/MS图谱显示,Zeno阱可提供明显的灵敏度增益(图10)。

图10. Zeno阱激活时灵敏度提升。TVDGPSGKmaLWR肽段 (m/z 656.3320) 采用EAD模式(KE=5 eV)在(A)未激活和(B)激活Zeno阱时的MS/MS谱图。当与EAD结合使用Zeno阱时,可观察到信号强度和图谱质量的显著改善,使PTM定位更明确。

同样,ZenoTOF 7600系统对于蛋白质磷酸化的分析中也提供了更多有利的信息,对磷酸化位点的定位和定量都很有帮助。CID对磷酸化肽段进行PTM位点定位及定量时,小的y离子和大的b离子往往难以检测,此外,CID MS/MS会诱导一些不稳定磷酸化肽段上的H3PO4 (-98 m/z)的中性丢失(图4B, D)。幸运的是,使用EAD分析能够检测到含有PTM的位点特异性离子,并且具有很好的信号强度,为每个肽段上的磷酸化位点提供了直接的证据(图11A, C),对于一个序列中包含多个磷酸化位点的肽段,可以做到精确定位。

图11. EAD解离使不稳定的磷酸基团得以保存。在Skyline中提取 (A, B) LITVDGNICpSGKSK和 (C, D) LITVDGNICSGKpSK在 (A, C) EAD模式 (KE=2)和 (B, D) CID模式下分析的磷酸化异构体。在EAD模式下,不稳定的磷酸基团被保留。
参考文献:
1.Nishida Y, Rardin MJ et al. (2015) SIRT5 regulates both cytosolic and mitochondrial protein malonylation with glycolysis as a major target. Mol Cell, 59:321-32.
2.PTM site localization and isomer differentiation of phosphorylated peptides – Tunable electron activated dissociation (EAD) MS/MS using the ZenoTOF 7600 system. SCIEX technical notr RUO-MKT-02-13174-A.
3.Qualitative flexibility combined with quantitative power. SCIEX technical note, RUO-MKT-02-13053-A.
声明:版权为 SCIEX 所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权, 转载时须注明「来源:SCIEX」。申请授权转载请在该文章下“写留言"。

喜欢就点在看哟