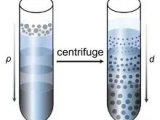
19世纪50年代的大鼠肝脏灌流-通气装置示意图[1]
19世纪50年代的大鼠肝脏灌流-通气装置示意图[1]

gentleMACSTM肝脏灌流技术具有如下优势:
温和高效,高得率,高活力
优化的整体解决方案,结果可靠易重复
操作简便快捷,新手轻松上手
离体处理解剖肝叶,灵活利用动物样本

观看视频,了解gentleMACS灌流技术如何轻松分离高活力肝脏细胞。




参考资料:
[1] Miller LL, Bly CG, Watson ML, Bale WF (1951) The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine 94(5): 431-453.
[2] Berry MN & Friend DS (1969) High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology 43(3): 506-520.
[3] Seglen PO (1976) Preparation of isolated rat liver cells. Methods in Cell Biology 13:29-83.
[4] Edström S, Ekman L, Ternell M, Lundholm K (1983) Isolation of mouse liver cells: perfusion technique and metabolic evaluation. European Surgical Research 15(2): 97-102.
[5] Meyer J, Gonelle-Gispert C, Morel P, Bühler L (2016) Methods for Isolation and Purification of Murine Liver Sinusoidal Endothelial Cells: A Systematic Review. PLoS One 11(3): e0151945.
[6] Cabral F, Miller CM, Kudrna KM, Hass BE, Daubendiek JG, et al (2018) Purification of Hepatocytes and Sinusoidal Endothelial Cells from Mouse Liver Perfusion. Journal of Visualized Experiments 132: e56993.
[7] Liu J, Huang X, Werner M, Broering R, Yang D, et al (2017) Advanced Method for Isolation of Mouse Hepatocytes, Liver Sinusoidal Endothelial Cells, and Kupffer Cells. Methods in Molecular Biology 1540: 249-258.