摘要 随着“一小时酵母蛋白质组”的实现, 短梯度下实现蛋白质组深度覆盖成为可能。本文利用全新Q-OT-qIT三合一质谱系统进行“一小时蛋白质组”分析与优化。50 min有效梯度, 单次实验分别从1 μg和50 ng HeLa全蛋白中鉴定到20860和14100条肽段, 对应到3865和2877个非冗余蛋白, 而目前的文献报道至少需要2~3 h。同时, 本文考察了Q-OT-qIT碎裂模式、检测方法、最大注入时间和自动增益控制等参数对蛋白质组快速分析的影响, 证明了不同采集方法间的互补性, 阐述了不同扫描参数对鉴定结果的影响。此外, 还讨论了Q-OT-qIT的并列运行原理和扫描组合模式, 为不同实验目的和样本类型的蛋白质组快速分析奠定了基础。
关键词 蛋白质组学 快速鉴定 深度覆盖 静电场轨道阱 Q-OT-qIT质谱
蛋白质组深度覆盖分析(in-depth proteome)已成为蛋白质组学研究的发展趋势, 通过大规模鉴定和挖掘极低丰度的蛋白, 为信号通路、分子靶点和生物标志物的研究提供重要信息。然而, 由于全蛋白样本的复杂性, 蛋白质组深度鉴定对色谱分离要求很高, 通常需要进行二维分离(强阴离子交换、高pH反相等), 或使用一维长梯度分离, 以降低高丰度蛋白的干扰[1,2]。但这样消耗了大量时间, 重现性也不佳, 成为蛋白质组深度覆盖研究的瓶颈。
静电场轨道阱(orbitrap)质量分析器具有超高分辨率、超高灵敏度等特点, 有效推动了蛋白质组学的发展[3,4]。新型Q-OT-qIT(Orbitrap Fusion)质谱系统首 次将四极杆(quadrupole, Q)、静电场轨道阱(orbitrap, OT)和线性离子阱(linear quadrupole ion trap, qIT)3种质量分析器集为一体, 利用动态扫描管理技术, 实现了3种质量分析器同时工作并相互协作, 一级、二级扫描同时进行, 使分析效率达到最大化[5]。Hebert等人[6]利用Q-OT-qIT质谱, 5次重复实验, 在70min有效梯度下鉴定到约4000个酵母蛋白, 同样的结果, 目前的文献报道至少需要4h, 分析效率(单位时间蛋白鉴定数量)提高了4倍以上[7,8]。基于此,Hebert等人[6]首次提出“一小时酵母蛋白质组”的概念, 即1h左右的短梯度实现酵母蛋白质组深度覆盖。蛋白质组学已进入新的时代。
本文使用Q-OT-qIT质谱系统对HeLa和酵母细胞全蛋白进行短梯度快速鉴定, 并对基于Q-OT-qIT质谱的“一小时蛋白质组”深入考察与优化。结果显示, 单次实验、50min有效梯度, 分别从1 μg和50 ng HeLa中鉴定到20860和14100条肽段, 对应3865和2877个非冗余蛋白, 分析效率相比目前的报道提高了至少2~3倍[9]。本文还对比和优化了多种扫描组合和参数设置, 为各类实验提供了最合适的采集模式。
1 材料与方法
1.1 样品前处理
分别取适量HeLa和酵母细胞沉淀, 加入含7 mol/L尿素、2 mol/L硫脲、1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)和50 mmol/L二硫苏糖醇(DL-dithiothreitol,DTT)的蛋白提取液(使用前加入蛋白酶抑制剂), 在超声细胞破碎仪中超声3×5s. 冰上放置20min后, 于4℃离心30min(15000×g)并取上清, Bradford法测定总蛋白浓度.
向蛋白提取液中加入DTT, 使终浓度为10 mmol/L, 于56℃振荡30min. 再加入碘乙酰胺(iodoacetamide, IAM), 使终浓度为50 mmol/L, 于室温避光振荡40min. 反应后, 加入6倍体积的预冷丙酮, 20℃放置3h, 再于4℃离心30min (15000×g)弃上清. 按10 μg/μL的浓度将沉淀重溶于50 mmol/LNH4HCO3缓冲溶液, 并加入足量胰蛋白酶(trypsin), 37℃酶解过夜. 酶解后, 将全蛋白酶解液稀释至终浓度为0.5 μg/μL.
1.2 纳流液相色谱方法
色谱仪: 纳流速超高效液相色谱EASY-nLC 1000(Thermo, 美国); 色谱柱: 纳流C18EASY-Spray柱(2 μm, 100 Å, 75 μm×25 cm/50 cm), 流速250nL/min; 自制纳流C18柱(3 μm, 100 Å, 75 μm×15 cm), 流速300nL/min; 流动相A: 0.1%甲酸-水溶液;流动相B: 0.1%甲酸-乙腈溶液.
50min有效梯度: 0~2min, 3%~5% B; 2~42min, 5%~22% B; 42~52min, 22%~30% B; 52~55min, 30%~90% B; 55~60min, 90% B. 70min有效梯度: 0~5 min, 3%~8% B; 5~60min, 8%~20% B; 60~75min, 20%~30% B; 75~80min, 30%~90% B; 80~90min, 90% B.
1.3 质谱方法
质谱仪: Orbitrap Fusion(Q-OT-qIT)高分辨质谱仪(ThermoFisher, 美国); 离子源: EASY-Spray或Nanospray Flex纳升电喷雾源; 喷雾电压: 2.2 kV; 离子传输管温度: 275℃; RF-lens: 60%.
扫描模式: Top-speed; 循环时间: 3 s; 动态排除: 60 s.
一级扫描: 质量分析器,轨道阱; 扫描范围,m/z350~1800; 分辨率,120k; 最大注入时间,50 ms; 自动增益控制(AGC): 2e5.
二级IT扫描: 离子选择,四级杆; 选择窗口,2 amu; 质量分析器,离子阱(ion trap, IT); 扫描速度,Rapid; 最大注入时间,35 ms; AGC: 1e4; 碎裂模式,HCD; 碎裂能量, 35%.
二级OT扫描: 离子选择,四级杆; 选择窗口,2 amu; 质量分析器,轨道阱; 分辨率,15k; 最大注入时间,35 ms; AGC,1e5; 碎裂模式,HCD; 碎裂能量, 35%.
1.4 数据分析
数据使用Proteome Discoverer 1.4软件搜库鉴定. 搜索引擎: SEQUEST HT; 数据库: Uniprot人和酵母蛋白数据库; 蛋白酶: 胰蛋白酶(full); 最大漏切位点: 2; 母离子质量精度: 10 ppm; 子离子质量精度: 0.6 Da(qIT)/0.02 Da(OT); 固定修饰: Carbamidomethyl(C+57.021 Da); 可变修饰: acetyl(N-terminus+42.011 Da), deamidated(N, Q+0.984 Da), oxidation(M+15.995 Da). 搜库结果使用Percolator计算q值进行卡值. 同时, 使用Preview软件分析数据质量.
2 结果与分析
2.1 Q-OT-qIT短梯度分析HeLa和酵母蛋白质组
实验对1 μg和50 ng HeLa进行50min有效梯度采集, 对1 μg酵母全蛋白进行70min有效梯度采集, 采用OT-HCD-IT扫描模式, 一级轨道阱、二级离子阱扫描, HCD高能碎裂. 结果显示, 有效出峰时间蛋白酶解产物得到充分分离, 质谱响应良好(图1). 即使在50 ng的极低样本量下, 仍获得良好的分离效果和质谱响应(图1B).
1 μg HeLa样本在50min有效梯度内共获得53209张谱图, 平均每秒1.7张一级谱图、16.1张二级谱图, 平均每循环9.6张二级谱图; 酵母样本在70min有效梯度内共获得60295张谱图, 平均每秒1.8张一级谱图、12.5张二级谱图, 平均每循环6.9张二级谱图(表1). HeLa细胞比酵母复杂, 存在更多的蛋白, 因此获得更多的二级谱图. 此外, 在50 ng HeLa的极低样本量下, 总谱图数也达到41099张.
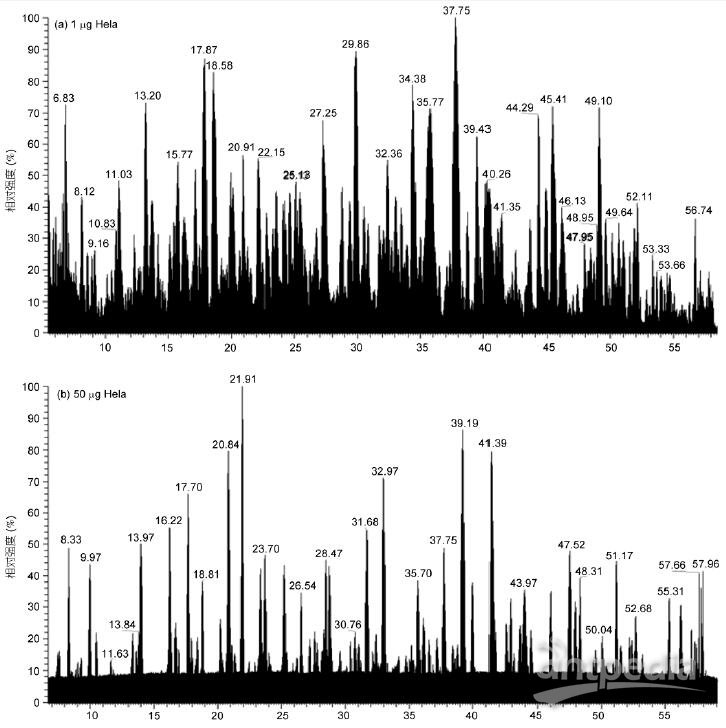
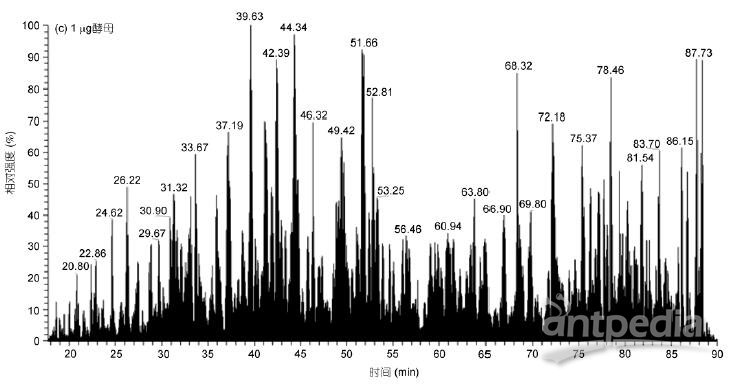
图1 HeLa和酵母蛋白酶解产物的LC-MS/MS总离子流图
A: 1 μg HeLa; B: 50 ng HeLa; C: 1 μg酵母