机制说明
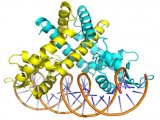
与所有在治疗上非常重要的酶一样,激酶不仅仅是化合物干预的单分子靶标。 在催化循环期间,激酶会结合蛋白质底物、ATP、中间物和产物(图 2)。 这些不同形式的酶也可能存在于很多不同的构象中。 所以,化合物可能指向不同形式的酶且不同的生化检验可能偏向不同形式的酶。 ATP 的生理浓度约为 2 mM,这表示 ATP 能够(通常非常有效地)与在 ATP 位点结合的化合物竞争。 因此,寻找可在 ATP 之前或之后结合的化合物(称作非竞争性化合物)或仅在 ATP 之后结合的化合物(称作抗竞争性化合物)对于激酶药物研发而言都是非常有吸引力的途径。 然而,很多历史悠久的激酶抑制剂都以酶的 ATP 位点为靶标,且预计在与酶结合时会和 ATP 竞争。 其他化合物可能以变构位点为靶标,预计不会与 ATP 竞争。 表征化合物的作用机制可以确定 ATP 或蛋白质底物的存在,对试验化合物亲和力的影响是提高、降低还是没有影响。 研究这种性质有助于了解分子水平的结构-活性关系 (SAR),其同时也是寻找新型药效的关键。

图 2:假定的蛋白质激酶催化循环。 在这个简化的示意图中,酶在催化循环期间结合底物和产物,所以在磷酸转移反应期间至少有四种酶形式。 这些不同的酶形式的每一种都将是动态的,且可以进入不同的构象,说明每种激酶可能代表化合物干预的多个不同靶标。 ITC 至少可以测量化合物与这些分离的酶形式中的一些形式的结合亲和力,有利于理解抑制剂结构-活性关系 (SAR)。
酶动力学检测法通常不是为了反应途径上发生的特定的酶形式而设计。 因此关于最大亲和力的相关酶形式的信息有时候很难直接获得。 ITC 通过测量对不同的预设酶形式的结合亲和力可以克服这个限制。 结合游离酶是最简单的方法,但是根据催化机制可以安排ITC 条件以探测其他酶形式,例如酶-蛋白底物、酶-ATP、酶-ADP 或酶-磷酸化产物复合物。 非可水解 ATP 类似物的使用在探测结合酶与两种底物的三元复合物的潜在化合物中也非常有用。
对某种蛋白激酶靶标进行了关于表征 ATP 对试验化合物结合的影响的实验。 对于一种试验化合物在存在和不存在 100μM ATP 时使用 Malvern MicroCal™ VP-ITC 进行 ITC滴定,对于 ATP 代表大约 60 × KD(图 3)。


图 3:非竞争性抑制剂结合。 在不存在(红线)和存在(蓝线)100 μM ATP 时试验化合物对蛋白质激酶靶标的滴定。 在不存在 ATP 时的参数值为 KD = 0.19 μM,ΔH = -17.4 kcal/mol,n = 0.9,在存在 ATP 时参数值为 KD = 0.17 μM,ΔH = -9.4 kcal/mol,n = 1.1。