前不久,来自加州大学旧金山分校(UCSF),西奈山医院(Mount Sinai),法国巴斯德研究所(Institut
Pasture),欧洲分子生物实验室(EMBL)等49个研究单位的125位研究人员合作完成了对SARS-CoV-2蛋白互作网络的分析。这项研究的结果于4月30日以标题
“A SARS-CoV-2 protein interaction map reveals targets for drug
repurposing”
发表在了Nature期刊。此次研究是迄今为止对SARS-CoV-2与人类宿主细胞之间蛋白互作网络最系统和深入的分析,揭示了新冠病毒在感染过程中如何操纵宿主细胞。通过复杂的网络互作图研究者们发现了多个针对宿主的蛋白靶点,而这些靶点所对应的已有药物和在研药物对于治疗COVID-19具有极大的潜能。
研究设计思路
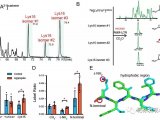
研究者们克隆并在人细胞系HEK293T/17中表达了29个SARS-CoV-2蛋白中的26个,然后用亲和纯化/质谱(AP-MS)确定了332个高置信度的SARS-CoV-2-人蛋白互作(PPIs)。从这些PPI中,他们找到了被69种已知药物(29个FDA批准的药物,12个处于临床实验阶段的药物,28个临床前化合物)靶向的66个人蛋白或宿主因子。接下来,来自美国西奈山医院和法国巴斯德研究所的两个团队各自利用Celigo免疫荧光成像分析和qRT-PCR的方法对一部分药物进行了体外实验筛选,发现两类化合物具有病毒抑制能力:1)mRNA转译抑制剂和
2)Sigma1和Sigma2受体的潜在调节剂。对这些靶向宿主因子的化合物进行更深入的研究,以及探索与靶向病毒蛋白的药物的联合使用,可能会成为COVID-19药物开发的新思路。
以下是此篇文章的重点结果和方法解读。
SARS-CoV-2宿主互作蛋白的全面分析
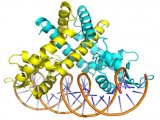
通过AP-MS, 研究者们确定了332个高置信度的SARS-CoV-2-人蛋白互作,并对这些人蛋白的生物学功能和组织表达水平进行了研究(Fig.
1a)。SARS-CoV-2的蛋白参与了一些重要的宿主细胞活动,包括脂蛋白代谢(S),细胞核运输(Nsp7),和核糖核蛋白复合物合成(Nsp8)(Fig.
1b)。在29个人类组织中,相关蛋白在肺中的表达水平最高(Fig.
1c)。在感染过程中,病毒蛋与其相互作的人蛋白的丰度变化有很强的相关性(Fig.
1d)。通过与其他病原体-宿主的蛋白互作网络图相比较,研究者们发现西尼罗病毒(WNV)和结核分支杆菌(Mtb)与SARS-CoV-2拥有最相似的网络分布(Fig.
1e)。值得注意的是,结核分支杆菌也可以感染肺组织。
蛋白互作网络图刷新了人们对SARS-CoV-2的认知
SARS-CoV-2与人蛋白之间复杂的互作网络涉及了多个复合物和生物过程,包括DNA复制,表观遗传和基因表达调控,囊泡运输,脂类修饰,RNA加工和调节,泛素连接酶,信号传导,细胞核运输,细胞骨架,线粒体和细胞外基质(Fig.
2)。大约40%的SARS-CoV-2互作蛋白与内膜或囊泡运输路径有关。这些互作可能在病毒进入宿主细胞时起到辅助作用。
研究还发现SARS-CoV-2与天然免疫信号传导相关蛋白有相互作用。比如Nsp13, Nsp15和Orf9b与IFN路径有关联;
Nsp13和Orf9与cNF-κB路径有关联。另外,两个调控抗病毒天然免疫信号传导的E3泛素连接酶,TRIM59和MIB1,分别和Orf3a与Nsp9相结合。
SARS-CoV-2还会影响宿主细胞蛋白的转译过程。病毒的核衣壳可以结合应激颗粒(SG)蛋白G3BP1/2,还有mTOR调控的转译抑制因子LARP1,
蛋白激酶CK2,mRNA降解因子UPF1和MOV10。应激颗粒的形成是最早发生的抗病毒反应之一。对应激颗粒和相关RNA路径进行操控在冠状病毒中很常见。由eIF4A抑制剂促进的G3BP聚集也许是其抗病毒能力的原理。