“如果一项决定没有强有力的科学依据,赛多利斯将通过科学研究来支持该依据”
作者 | Hovery Yin、Elin Sun
编辑 | Johnson Wang、Hester Pan
2020年6月2日,国家药监局药品评审中心发布了《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(征求意见稿)》,阐述一种基于科学和风险的研究思路来开展注射剂生产过程中使用的塑料组件系统的相容性研究。
赛多利斯作为一家引领了可提取物科学(2‒10)并持续20多年为我们的产品发布可提取物数据的供应商,在多年的研究中发展,完善并建立了能够充分满足各个药品监管机构标准的内部方法来对一次性组件进行可提取物分析,用可提取物数据和服务来支持生物制药客户实施一次性产品。
为了定义我们的研究方法,我们需要询问和回答几个与研究目的、提取溶液、提取条件和分析方法有关的问题。其他考虑因素包括要提取的批次数量、报告限的定义和第三方组件。
“如果一项决定没有强有力的科学依据,赛多利斯将通过科学研究来支持该依据。”
各种可提取物方法的所有差异都源于一项研究的既定目的以及由此产生的数据的后续使用。例如,考虑讨论哪些特定的提取液应用于可提取物研究:
如果某个版本的维恩图没有显示浸出物是可提取物的子集,则可提取物和浸出物的介绍将不完整。在图1中,我们包含了一个针对工艺相关可提取物的中间类别。我们确定内部方法时,我们认为维恩图的最大部分应由供应商负责。
我们需要定义表征研究组件的潜在可提取物的范围,并在材料选择、早期毒理学风险评估和变更控制方面提供帮助。这个意图驱动了我们整个方法的定义。
如果目的是生成数据以模拟生物工艺条件,那么实际的溶液(例如缓冲液)可能是正确的提取液。然而,如果一项研究的目的是对组件进行化学表征,那么更具侵蚀性、提取能力更高的溶液可能更为合适。在确定新的可提取物方法的过程中,这个逻辑驱动了许多决策。
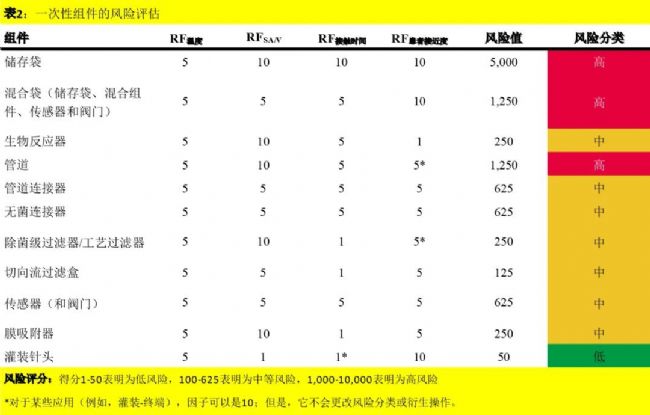
1. 一次性组件的风险评估与分类
赛多利斯对可能留在工艺流体中并最终转移到活性药物成分(API)的化合物的提取进行了风险评估。该评估是根据Merseburger等人发表的行业和权威观点进行的(11, 12)。确定了风险因素,如温度、表面积与体积的比值、接触时间、与靠近患者的因素等,因为它们影响生物制药工艺中一次性组件的可提取物浓度。同时考虑了可能稀释、浓缩或去除工艺流中浸出物的所有纯化步骤。
提取溶剂的影响不属于本风险评估的一部分。可提取物研究的目的是寻求全面的信息。因此,赛多利斯对适当溶剂的选择进行了深入的研究(4)。
为了确定每个因素的风险值(表1),我们考虑在整个生物制程中使用一个一次性组件。通过将每个风险值乘以1、5或10来计算每个一次性组件的风险分数。最后,将风险分为三类:低风险(L)、中等风险(M)和高风险(H)(表2)。