例1
女,40岁,因"咳嗽半月余"以"肺炎"于2015年9月22日收入院。外院肺CT:右下肺炎首先考虑。抗感染1周,临床症状及影像学均无明显吸收。入院查体无明显阳性体征。血常规:WBC 3.5×109/L,NEUT 71.2%,CRP 2 mg/L。肿瘤标志物:CA125 57.9 μg/L,余正常。
肺CT:两肺尖少许纤维增殖灶,右肺下叶感染性病灶考虑,趋向实变(图1A、图1B)。腹部B超:肝血管瘤,胆囊息肉样变,未见腹腔内淋巴结肿大。正电子发射计算机断层显像(PET-CT):右下肺大片实变影,炎症首先考虑;右侧胸膜增厚,左侧胸腔少量积液。予哌拉西林舒巴坦+可乐必妥抗感染2周,复查肺CT:右下肺病变较前大致相仿。
行气管镜检查:右下叶基底段开口狭窄,黏膜表面凹凸不平(图1C),右下叶后基底段b支距开口4 cm处低回声区(图1D),行该部位黏膜活检及刷检。
病理:黏膜组织内见大量小至中等大小淋巴细胞浸润,(刷检)见少许核异形细胞伴严重退变;结合形态及免疫组化,符合支气管黏膜相关的淋巴结组织(brochial or mucosa associated lymphoid tissue,MALT)型边缘区B细胞淋巴瘤,CK肺泡上皮(+),转录中介因子1(TIF-1)肺泡上皮(+),淋巴细胞CD20(+),PAK-5(+),CD79α(+),CD43(-),CD3(-),CD5(-),CD21(+),CD10(-),Bcl-2(+),Bcl-6(+),CD23(-),细胞周期素D1(CyclinD1)(-),末端脱氧核苷酸转移酶(TDT)(-),Ki-67(+)2%~5%。
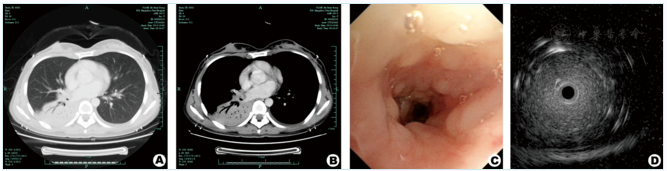
图1例1病例的肺CT、常规气管镜、超声支气管镜的表现 A、B分别是肺窗和纵隔窗表现,右下肺实变影,内可见支气管充气征,提示感染性病灶考虑;C:常规气管镜下见右下叶基底段开口狭窄,黏膜表面凹凸不平;D:超声镜下见右下叶后基底段b支距开口4 cm处低回声区
例2
男,66岁,以"反复咳嗽8月余"于2015年11月10日入院。8个月前曾有咳嗽咳痰伴发热,当时对症治疗。3个月前当地肺部CT示右下肺感染性病灶,考虑"肺炎",先后以阿洛西林+异帕米星、头孢他啶抗感染,病灶无明显吸收。
入院查体无异常。B超:肝多发囊肿,肝血管瘤,前列腺增生,未见腹腔内淋巴结肿大。血常规:WBC 4.6×109/L,NEUT 53%,CRP 1 mg/L。肿瘤标志物:CYFRA21-1 4.9 μg/L,余正常。自身抗体:抗核抗体(ANA) 1∶100,余阴性。血管炎抗体、T细胞斑点试验(T-SPOT)、G试验、GM试验均正常。
肺CT:右肺下叶团块影,感染性病灶首先考虑(图2A、图2B)。常规气管镜下未见异常,超声镜下见右下叶后基底段a支距开口5 cm处低回声区(图2C),该部位行TBLB,病理:大量小至中等大小淋巴细胞聚集,以B系淋巴细胞为主,并有淋巴上皮病变,考虑为MALT型边缘区B细胞淋巴瘤;免疫组化:CK示残存上皮(+),TIF-1有肺泡上皮残存,LCA(+),CD20(+),PAK-5(+),CD3少量(+),CD5少量(+)表达与CD3相同,CD23(-),CD21(+),CD43少量(+),CylinD1(-),Ki-67(+)5%~10%。胃镜、肠镜、后腹膜B超均未见肿瘤证据。骨髓穿刺:造血细胞增生低下,未见肿瘤累及。PET-CT:右下肺大片实变影伴脱氧葡萄糖(FDG)代谢不均匀增高,余无明显肿瘤累及证据。

图2例2病例的肺CT、超声支气管镜表现 A、B分别是肺窗、纵隔窗表现,右肺下叶团块影,感染性病灶首先考虑;C:超声镜下示右下叶后基底段a支距开口5 cm处低回声区
讨论
原发性肺淋巴瘤(primary pulmonary lymphoma,PPL)是原发于肺内淋巴组织的恶性淋巴瘤,是结外淋巴瘤的一种罕见类型,绝大多数为非霍奇金淋巴瘤(NHL),其中多数起源于MALT。由于PPL的临床表现和影像学特点缺乏特异性,极易误诊、误治。
PPL的诊断标准是:(1)有明确组织病理学依据,累及肺、肺门或初级支气管,有或无纵隔受累;(2)无其他淋巴结或结外组织器官累及;(3)发病后3个月仍未出现胸外淋巴瘤的证据。PPL中最常见的是起源于MALT的低度恶性小B细胞淋巴瘤,占所有PPL的70%~85%;本文中的2例均经病理证实为MALT淋巴瘤。PPL病因不明,目前大多认为MALT在生理状态下并不存在,而是在某种抗原如吸烟、感染等的长期刺激下逐渐产生,是机体的一种防御反应。
PPL的临床表现缺乏特异性。可表现为发热、盗汗、纳差、体重下降,或咳嗽、咳痰、呼吸困难、咯血等。接近50%的患者无症状,直到胸部影像学检查才发现肺部病灶;本文中2例最初均误诊为肺炎。肺部体征也无特殊性。
PPL的影像学特征亦缺乏特异性,以肺炎肺泡型、结节肿块型多见,还有双肺弥漫性网格影、磨玻璃影或粟粒型,或上述多种形态混合存在。尤其在多发不同类型病灶中出现磨玻璃结节影,提示肺淋巴瘤的诊断,此点可与肺腺癌相鉴别。50%的病例中可见支气管充气征或呈"枯树征",近10%的病例可表现为胸腔积液,5%~30%的病例表现为淋巴结增大。本文报道的2例患者均为单肺的片状或实变影,最初CT诊断均误诊为肺炎。因此当肺内出现单发肿块、多发结节及肺实变影,病情进展缓慢,临床表现与影像特征不符合,或经常规治疗效果不佳时,应考虑到本病的可能性。
PPL的确诊依赖于组织病理学。由于PPL累及支气管内膜罕见,且活检标本偏小,故文献报道经支气管镜下活检阳性率偏低,以往的诊断方式主要依赖于胸腔镜、开胸活检或肺叶切除手术,但最近研究发现经皮肺活检或支气管镜下肺活检亦可取得合适的标本以确诊该病,或者通过多种活检方法、多次活检提高阳性率。本文中2例均为径向超声微探头引导下的TBLB得以确诊。
得益于目前超声支气管镜的蓬勃发展,在对肺外周病变进行支气管镜检查时,使用径向探头进行支气管腔内超声(EBUS)主要被用于对活检路径进行引导,从而对靶病变的位置进行实时确认,极大提高了对周围性病变的识别和定位能力,从而大大提高了肺活检的阳性率。作为一种新兴技术,EBUS是对传统技术的一种改进和补充,不仅安全、可行,而且阳性率高,并被评为"2007年最具影响力的技术"而在全世界范围内迅速推广。
组织病理学结合免疫组化能对大多数有典型病变的淋巴瘤进行诊断。其病理特点为光镜下可见支气管黏膜下小淋巴细胞、边缘带及单核细胞样B细胞和浆细胞的浸润,部分可见肿瘤细胞浸润并破坏支气管的黏膜上皮或腺上皮,形成淋巴上皮病损。免疫组化提示肿瘤细胞表达泛B抗原(CD19,CD20,CD22,CD79α),但不表达CD5、CD10、CD23、Bcl-1。
PPL的治疗无统一标准,其预后与病理类型相关。其中,低度恶性的MALT淋巴瘤其临床进展是惰性的,可长期局限于肺内而不扩散,从发病到确诊最长时间可有12年,预后良好。MALT淋巴瘤如病灶局限且无症状,可采取"观察和等待"的治疗方案;高度恶性的大B细胞淋巴瘤一般不推荐手术,以化疗为主;病灶局限可采取手术或放疗的方式;病灶弥漫或累及肺外时以全身化疗为主。
总之,原发性肺淋巴瘤的临床表现缺乏特异性,影像学具备多态性、多灶性的特点,常可见支气管征或"枯树征",有一定诊断价值;尤其是肺内病灶无法用一般肺部疾病解释,且常规治疗效果欠佳时,应考虑到本病的可能性。并尽可能取得足够组织标本进行病理检查结合免疫组化,以便尽快明确诊断。其中EBUS引导下的气管镜下活检具有创伤小、安全性高、阳性率高等特点,在PPL的诊断中发挥越来越大的作用。EBUS技术已受到广泛关注,目前所观察到的也许仅仅是个开始;随着EBUS设备的不断完善,其应用范围将进一步拓展,这一技术必将在肺部疾病的诊断和治疗中发挥越来越大的作用。