C3肾小球肾炎转为单克隆IgG沉积的增生性肾小球肾炎病例分析
病例资料
现病史 58岁女性患者,因“水肿、尿检异常12年,血清肌酐(scr)及血压升高5月”2014-05-20入院。
2002年患者因颜面部水肿查尿蛋白阳性(定量不详),隐血++,SCr及血压均正常,服中成药(具体不详)治疗6月,水肿消退、尿蛋白转阴,然尿隐血持续++。2011年4月再次出现颜面部水肿,查尿蛋白++,隐血++,SCr正常,仍服中成药治疗,尿蛋白-~++,隐血-~+++。
2012-02-16住我院查血压正常,蛋白尿定量0.69 g/24h,尿沉渣红细胞计数(RBC)20万/ml(多形型),血红蛋白(Hb)104 g/L,肝肾功能正常,补体C3、C4及血、尿轻链正常,免疫固定电泳未见单克隆免疫球蛋白条带,肾活检示“肾小球重度系膜增生性病变伴C3沉积”,予“大黄素”、“金水宝”等治疗,随访期间查尿蛋白定量0.1-0.3 g/24h,尿RBC 1.0万~48万/ml,SCr波动于87~99 umoL/L。
2014年1月双下肢水肿再现,尿蛋白增至1.249/24h,尿RBC 110万/ml(多形型),SCr升至111 umoL/L,血压149/70 mmHg,加服“替米沙坦”等治疗。
但血压仍进行性升高(最高达180/80 mmHg),SCr渐升,蛋白尿、血尿加重,加服万方数据雷公藤多甙(60 mg/d)治疗2月效果不佳,再次收住院。病程中精神、体力、食欲、睡眠正常,体重变化不详。
既往史及个人史 无特殊。
家族史 父亲因“肺心病”去世,母亲患“高血压、脑血栓”,因脑卒中去世,有2个妹妹及1子未做尿检,2个女儿尿检正常。
体格检查 血压156/88 mmHg,心、肺、腹体检未见明显无异常,双下肢中度凹陷性水肿。
实验室检查
尿液 蛋白定量2.5 g/24h,RBC 60万/ml(多形型);C3 2 mg/L;α2-M2mg/L;NAG 69.1U/g·cr,RBP 20.5 mg/L,溶菌酶6.6 mg/L。禁饮13h尿渗量362 mOsm/Kg·H20;尿游离轻链κ 192.34 mg/L,λ122.08mg/L,κ/λ=1.58。尿本周蛋白阴性。
血常规 Hb 90 g/L,WBC 4.2×109/L,PLT 152×109/L。
血生化 白蛋白24.4 g/L,球蛋白14.7 g/L,SCr 184 umoL/L,总胆固醇7.22 mmoL/L,三酰甘油1.65 mm01/L,空腹血糖4.62 mmoL/L,电解质正常。C反应蛋白0.1 mg/L。
免疫学 IgG 3.13 g/L,IgA、IgE、IgM正常,类风湿因子及抗链“O”(ASO)正常,ANA、ds-DNA、抗核抗体谱阴性。血游离轻链κ 82.91 mg/L,λ 48.58 mg/L,κ/λ=1.71。血清免疫固定电泳未见单克隆免疫球蛋白条带。补体C3 0.756 g/L,C4 0.130 g/L,C3肾炎因子阴性,补体H因子正常、抗补体H因子抗体阴性。冷球蛋白51.43 mg/L(参考值<192 mg/L)。
其他 传染病四项阴性。
辅助检查
心电图 (1)窦性心律;(2)完全性右束支传导阻滞;(3)P-R间期缩短。
超声 甲状腺:双侧甲状腺结节,双侧甲状旁腺区声像图未见占位。肝胆胰脾:(1)胆囊继发性改变;(2)腹水;(3)肝胰脾声像图未见占位。双肾:左肾91 mm×42 mm×45 mm,右肾:93 mm×39 mm×46mm,皮质厚度不清,皮质回声稍增强,皮髓界限清楚、集合系统正常。
眼底检查 黄斑区色素紊乱,视网膜正常,动静脉比例1:2,动脉硬化程度1级。
其他 (1)骨髓穿刺细胞学检查(两次)正常;骨髓活组织检查:右侧髂前上棘示骨髓组织增生。轻度低下。(2)胸片及上消化钡餐均正常。
肾活检病理首次肾活检(2012-03-07)
光镜 皮质肾组织2条。41个肾小球中3个球性废弃。余肾小球系膜区重度增宽,系膜细胞增生、基质增多(图1A);毛细血管袢开放好,囊壁节段增厚、分层。
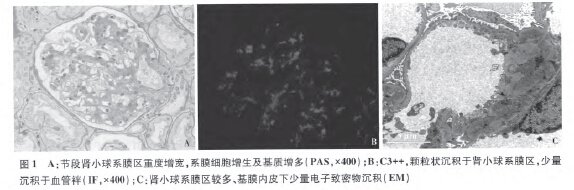
PASM-Masson:肾小球系膜区大量嗜复红物沉积。肾小管间质慢性病变轻度,灶性小管萎缩、基膜增厚,管腔内少量蛋白管型,间质灶性纤维化,少量单个核细胞浸润。小叶间动脉内膜增厚。
免疫荧光 C3++(图1B)、Clq+,呈颗粒状弥漫分布于肾小球系膜区及血管袢。IgG、IgA、IgM阴性。石蜡切片重染IgG仍为阴性。κ轻链、λ轻链阴性。
电镜 肾小球系膜区增宽,系膜区较多高密度电子致密物,节段基膜内皮下亦见少量电子致密物沉积(图1C),有的致密物沿肾小球基膜(GBM)内侧缘沉积,上皮侧偶见电子致密物,其中未见特殊结构。肾小球毛细血管袢开放好,袢内偶见内皮细胞成对,见单核细胞及中性粒细胞浸润。GBM厚260-490 nm,节段GBM与GBM黏连。肾小球足细胞足突融合10%~20%。
重复肾活检(2014-05-23)
光镜 30个肾小球中7个球性废弃,1个纤维细胞性新月体。余肾小球呈分叶状,系膜区中~重度增宽,系膜细胞增生伴基质增多,偶见系膜溶解,毛细血管袢开放尚好,较多内皮细胞成对,单个核细胞5-25个/球,见泡沫细胞(图2A),节段囊壁增厚、分层,囊周纤维化。
PASM-Masson:肾小球系膜区、内皮下较多、上皮侧偶见嗜复红物沉积,较多肾小球基膜分层。肾小管间质急性病变中度,灶性肾小管刷状缘脱落,可见蛋白管型及脱落的小管上皮细胞,肾间质灶性单个核细胞浸润;合并慢性病变轻度,灶性肾小管萎缩、基膜增厚。小叶间动脉内膜增厚。
免疫荧光 IgG++(图2B)、C3++、C1q+,呈颗粒状弥漫分布于系膜区及血管袢,IgA、IgM阴性。IgG3++(图2C),κ轻链++(图2D)、λ轻链±~+,呈颗粒状弥漫分布于系膜区及血管袢。IgGl、IgG2、IgG4阴性。
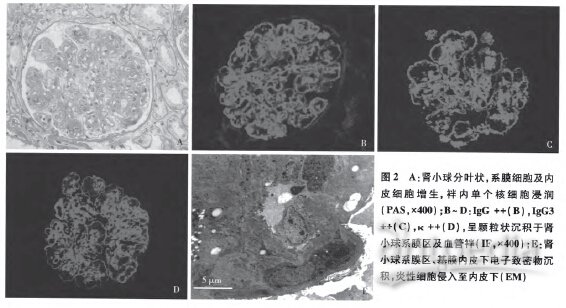
电镜 肾小球系膜区增宽,系膜区较多高密度电子致密物沉积,多处GBM内皮下亦见电子致密物沉积(图2E),较多高密度电子致密物沿基膜内侧缘沉积,上皮侧偶见电子致密物,其中未见特殊结构。肾小球毛细血管袢开放尚好,见系膜插入、新的基膜形成,袢内见单核细胞及淋巴细胞浸润,有的炎性细胞侵入至内皮下,节段袢腔狭窄(图2E)。肾小球节段GBM与GBM黏连。肾小球足细胞足突融合80%~90%。
综合临床病理,最终诊断为C3肾小球肾炎(C3GN)转变为单克隆IgG沉积的增生性肾小球肾炎(PGNMID)(IgG3-κ型)。
讨论
中年女性患者,慢性病程,首诊时临床表现轻度尿检异常及贫血,血压不高,补体及血轻链比例正常,肾活检显示肾小球重度系膜增生性病变免疫荧光C3沉积,诊断符合C3GN。
随访过程中尿检一度转阴,近5月出现病情加重,血压明显升高,尿蛋白、镜下血尿增加,SCr逐步升高,贫血加重,补体轻度下降,血轻链κ/λ比例增高,血清免疫固定电泳未见单克隆免疫球蛋白条带,骨髓活检和骨髓细胞学检查均阴性,重复肾活检显示PGNMID(IgG3-κ型)。
C3肾小球病是新近提出的补体旁路途经调节异常伴C3沉积的一类肾小球疾病,包括C3GN和致密物沉积病(DDD)。C3GN的病理特征包括:(1)光镜下以MPGN常见,亦可呈肾小球系膜增生性病变、弥漫增生性肾小球肾炎、新月体肾炎或硬化性肾小球肾炎;(2)免疫荧火C3≥2+,伴/不伴免疫球蛋白(±~+);(3)电镜下以肾小球系膜区及内皮下大量沉积物为主,上皮侧或膜内沉积物少见,沉积物形态类似于免疫复合物。
C3GN需与以下疾病相鉴别:(1)DDD:光镜以MPGN常见,免疫荧光主要为C3沉积于GBM、部分。肾小管基膜(TBM)、甚至球囊壁,最具特征性的特点,也是诊断的必须条件,即电镜下GBM致密层、伴TBM内极高密度的电子致密物沉积,本例患者的超微结构未见GBM致密层、TBM内高密度的电子致密物沉积,因此不支持DDD的诊断;
(2)急性链球菌感染后肾小球肾炎:常见肾小球毛细血管内增生性病变及C3沉积,并以电镜下肾小球基膜上皮侧“驼峰”形成为特征性改变,该患者电镜下未见“驼峰”,活检前无前驱感染病史,AS0、C3正常,亦不符合。因此,结合光镜、免疫荧光、电镜,该患者首次活检诊断符合C3GN。
PGNMID是单克隆IgG沉积相关的肾脏疾病的一种病理类型,病理改变以MPGN及弥漫增生性肾小球肾炎常见,少数为肾小球系膜增生性病变、肾小球膜性病变;免疫荧光肾小球IgG、C3沉积为主,可伴Clq沉积,仅有单一IgG亚型和单一轻链在肾小球沉积,IgM、IgA阴性;电镜下见肾小球系膜区、基膜内皮下伴/不伴上皮侧电子致密物沉积,超微结构类似于免疫复合物介导的肾小球肾炎。
PGNMID需要鉴别以下疾病:(1)轻.重链沉积病:单一IgG亚型和单一轻链线状沉积于GBM和TBM,电镜可见GBM内侧缘和TBM外侧缘颗粒状电子致密物沉积,而本例患者免疫病理和超微结构均不符合;
(2)免疫管状肾小球病(ITG)和纤维性肾小球肾炎(FGN):ITG的沉积物超微结构为平行排列的中空微管状物(直径30~60 nm),FGN的沉积物为无分枝、无序排列的纤维丝(直径10~30 nm),该患者沉积物的超微结构特点不支持ITG或FGN;(3)I型冷球蛋白血症:IgM型多见,少数为IgG型,电镜下可见弯曲微管状或指纹状结构,本例患者血冷球蛋白在正常范围,不支持该诊断。
本例患者免疫病理为IgG、C3沉积,IgG亚型及轻链染色提示单克隆IgG3-κ,电镜下肾小球沉积物未见特殊结构(纤维状、微管状、指纹状、晶格状等)。因此,该患者重复活检诊断PGNMID成立。C3肾小球病与补体旁路途经调节异常有关,可继发于单克隆免疫球蛋白病。
zand等报道32例C3GN中10例合并单克隆免疫球蛋白病,平均年龄54.5岁,单克隆球蛋白(M蛋白)均阳性,其中5例为意义未明的单克隆免疫球蛋白病(MGUS)、1例为慢性淋巴细胞性白血病(CLL),6/9例C3下降。Bridoux等及Hill等亦报道了类似的病例。
此外,有文献报道MGus相关的DDD,其发病机制可能与单克隆免疫球蛋白作为补体旁路途径调节蛋白的抗体,使补体旁路途径异常活化,最终形成C3肾小球病。
PGNMID也可继发于单克隆免疫球蛋白病。Nasr等报道29.7%的患者存在异常蛋白血症,骨髓活检绝大多数患者浆细胞<5%,1例患者仅存在血轻链κ/λ比值增高,随访过程中1例出现骨髓瘤。Masai等报道的4例PGNMID中1例存在骨髓瘤。
曾彩虹等报道的7例PGNMID患者,1例M蛋白阳性。M蛋白作为免疫球蛋白中的一类特殊形式,也可以通过激活补体经典途径形成MPGN样改变。
该患者重复活检时出现了血κ/λ比例升高,尽管血中未能检测出M蛋白,但仍需随访观察是否进展为单克隆免疫球蛋白病。
C3GN或PGNMID中曾进行重复活检的病例及移植前自体肾、移植肾活检尚未见C3GN转变为PGNMID的报道。zand等报道的单克隆免疫球蛋白病相关的C3GN中,5例自体肾(其中1例免疫荧光C3沉积为主伴C1q±)的重复活检免疫荧光均未见IgG沉积。
Bridoux等报道的单克隆免疫球蛋白病相关的C3GN中1例患者重复活检时除C3沉积外,新出现入轻链的沉积,但无IgG沉积。
zand等报道的移植后C3GN复发的患者中,4/14伴IgG沉积,强度仅为±~+。其他文献报道的C3GN病例重复活检免疫病理均未见变化。
Nasr等及Fujiwara等报道的PGNMID个案两次肾活检的免疫病理一致。移植后复发的PGNMID的病例报道中,移植肾活检的免疫病理均与自体肾一致,未出现单独C3沉积的病理改变。
该患者最突出特点是两次肾活检病理形态发生了显著变化,而这两种病理形态先后在同一个体中出现,可能存在两种解释。其一是同一疾病的不同发展阶段(一元论),首次活检时患者处于PGNMID的早期阶段,异常的免疫球蛋白激活补体并沉积于肾小球中,随着病情进展最终形成了典型PGNMID。
值得注意的是,首次活检时免疫病理除了C3++沉积外,同时伴C1q+沉积。目前报道的C3GN系列中,极个别病例伴C1q沉积,强度为±~+,C1q在C3GN中的沉积并不是常见现象,提示其发病机制上可能存在不同于一般C3GN的特殊之处。
其二是同一个体先后发生的两种独立的疾病(二元论),单克隆免疫球蛋白病可通过直接机制(补体经典途径)介导形成C3GN,间接机制(补体旁路途径)介导形成PGNMID,即C3GN和PGNMID两者继发于相同临床疾病背景一单克隆免疫球蛋白病,该患者在首次活检时仅存在补体旁路途径的活化,形成C3GN,而在二次打击下,补体经典途径活化,最终形成PGNMID。
本文发现C3GN和PGNMID在同一患者中先后出现,表明在疾病治疗过程中加强随访以及重复活检的重要性。C3GN是补体旁路途经调节异常所致以C3沉积为主的肾小球疾病,PGNMID是一类B细胞克隆增殖产生单克隆免疫球蛋白沉积的肾小球疾病,两者均可继发于单克隆免疫球蛋白病,本文报道的个案可能有助于进一步阐明这两类疾病发病机制的内在联系。