病例资料
患者女,38岁,因雷诺现象6年,发作性失语、肢体运动障碍2年入院。入院6年前,患者开始出现双手指遇冷变白后变紫再变红,保暖后可恢复,且渐感手指肿胀、皮肤稍变硬,但未诊治。
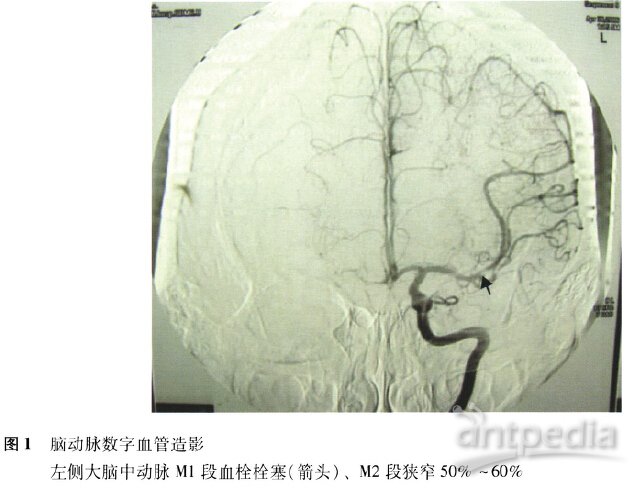
入院2年前,患者无诱因出现头晕,伴恶心、非喷射性呕吐、一过性黑朦,血压正常;数天后,突发言语不能、口角歪斜,于当地行脑动脉数字血管造影,示左侧大脑中动脉Ml段血栓栓塞、M2段狭窄50%一60%(图1),遂予经导管局部溶栓及抗凝、抗血小板治疗后闭塞血管再通,症状好转。
期间查血尿常规、C反应蛋白正常,抗核抗体1:3200(颗粒型)l:100(核仁型),抗可提取核抗原(extE∞table nucle盯粕tigen,ENA)抗体、抗双链DNA抗体、类风湿因子均阴性。
当地医院考虑诊断为结缔组织病,予泼尼松10 mg,d、羟氯喹100 mg,d及肠溶阿司匹林和尼莫地平治疗。头晕、失语症状未再发作,但手足雷诺现象无变化。此后泼尼松逐渐减量,1年后停用泼尼松和羟氯喹。
入院1个月前,患者再发左侧肢体无力,持续约2 min自行缓解,就诊于外院,再次加用泼尼松lO mg,d和羟氯喹治疗,未再发作。为进一步诊治人我院。
体检:血压115/75 mmHg,手指肿胀,双手指及手背皮肤硬,甲周可见红斑,无毛细血管扩张和皮下硬结;鼻唇沟对称,伸舌居中,口腔多发龋齿;心、肺、腹无异常;关节无肿胀和压痛,外周血管搏动正常,四肢肌力正常,病理反射未引出。
患者自发病以来间断出现口腔溃疡,否认外阴溃疡;口干、进干食需水送服,无眼干和腮腺肿大;无发热、光过敏和皮疹,无返酸和吞咽困难。既往史:无高血压和糖尿病史,否认吸烟和病态妊娠史,无特殊家族病史。
实验室检查:血尿常规、肝肾功能、血脂检测均正常;红细胞沉降率6mm/l h,C反应蛋白、补体及免疫球蛋白定量正常;抗核抗体+散点型l:640,抗着丝点抗体1:640;抗双链DNA抗体、抗ENA抗体、抗中性粒细胞胞浆抗体、抗Scl-70、抗心磷脂抗体及狼疮抗凝物均阴性。
口腔科检测:唾液流率0.01 ml/min (↓)。
眼科检测:右眼schirner试验0 mm/5min (↓),左眼schirner试验0mm/5min (↓);泪膜破碎时间右眼4 s (↓),左眼3 s(↓),符合干眼症。
唇腺活检病理示:腺泡轻度萎缩,小导管扩张,腺泡及导管周围见灶性及散在淋巴细胞、浆细胞浸润。
头颅磁共振血管造影(MRA):左侧大脑中动脉Ml段重度狭窄或闭塞,大脑后动脉远端重度狭窄;右侧大脑前动脉起始部及A1段、大脑后动脉P1段狭窄。颅内动脉多发狭窄或闭塞,结合病史考虑血管炎不除外。
头颅磁共振显像(MRI)+MRA(图2):双额顶叶皮层下、侧脑室旁及右侧壳核多发斑点状长r12信号,结合MRA考虑缺血性改变可能大。

下肢动脉彩色超声检查:左侧胫前动脉下段闭塞伴侧枝形成,左侧足背动脉频谱呈狭窄下游改变。下肢静脉超声检查及颈部血管彩色超声检查未见异常。食管+上消化道造影阴性。双手、双足x线检查未见异常。
甲褶微循环检查:毛细血管显著扩张,袢顶淤滞,红细胞聚集,可见多处出血。总积分6.40分,明显异常。
明确诊断为:系统性硬化症(SSc)局限性继发干燥综合征.
治疗:予泼尼松(10IIlg,1次/d)、环磷酰胺(0.2 g,隔日1次)静脉注射、羟氯喹(0.2 g,2次,d)、阿司匹林(0.1 g,1次/d),未再发作头晕等不适。环磷酰胺逐渐减量且应用1年后停用。随访3年,病情稳定。
讨论
本患者为青年女性,慢性病程,主要表现为雷诺现象和反复颅内动脉狭窄所致脑缺血,手指及手背皮肤肿胀变硬,抗着丝点抗体阳性、甲褶微循环示SSc活动期,SSc(局限性)诊断明确。口腔和眼科检查及唇腺活检诊断继发性干燥综合征。目前,SSc造成颅内动脉狭窄闭塞的相关报道较为少见。上世纪70年代开始陆续有SSc合并脑供血情况的报道。
Nobili等总结了27例无神经系统症状及高血压、肾脏损害等其他相关并发症的SSc患者资料,发现52%的患者可存在亚临床状态的大脑动脉灌注不足,但头颅多普勒超声检查并未发现脑血管狭窄。进一步研究表明,脑血流减少与患者年龄、疾病分期、心脑血管危险因素及甲褶微循环改变不相关,是SSc患者的独立病理过程。
但是,这些报道中仅1例可经超声检查发现脑动脉狭窄。亦有多项临床研究证实,SSc患者更容易出现影像学提示的脑白质缺血病灶,且可能与雷诺现象等血管病变相关。
关于SSc合并脑血管受累的病理生理机制亦有相关报道。文献报道2例病史较长的SSc合并缺血性脑病者,其脑活检均呈现血管壁钙化表现,而炎性反应并不严重。
研究指出,SSc合并脑血管病可能是由于脑血管痉挛、血管炎性改变等多种因素造成;而也研究表明,其病理生理改变可能有血管痉挛、非炎性微血管病、成纤维细胞增生导致纤维化等多种机制共同参与。
最近1项临床研究示,SSc患者动脉粥样硬化的风险较正常对照明显增加,且与血清中提示炎性、血管病及纤维化病理改变的细胞因子升高明确相关。
总之,目前关于SSc合并脑血管病的病理生理机制尚不明确,从上述文献可看到,可能是血管病、血管炎、血管痉挛等多重机制参与了SSc脑动脉病变的发病。结合本患者临床表现,其炎性指标正常,发病时间较长,考虑发病机制中急性血管炎并不突出,而可能以血管病病变为主。
此外,患者明确合并继发干燥综合征。据报道,临床上约有20%的干燥综合征患者合并神经系统病变,其中枢神经系统病变可表现为类似于多发性硬化的脊髓病改变。
报道显示,22例干燥综合征合并神经系统病变的患者中,有6例有中枢神经系统受累。有报道6例干燥综合征合并神经系统病变的患者中4例有中枢神经系统受累,其中1例头颅MRI有异常表现。后者报道提到,抗Ro/SSA抗体可能与干燥综合征合并神经系统病变发病相关,而其发病机制可能有血管炎和轴索病变。
而另1篇报道在53例干燥综合征患者中发现38例M砌有脑白质高密度病灶,提出这可能与中枢神经系统血管炎相关。从本患者临床隋况看,不能除外干燥综合征继发中枢神经系统病变可能,但患者抗ENA抗体阴性,并不支持该判断。
本患者的治疗一方面针对血管病,继续阿司匹林及尼莫同;另一方面针对原发病继续应用小剂量泼尼松,但加强了免疫抑制——环磷酰胺、羟氯喹的使用,患者未再发作脑梗塞。
目前,SSc合并影像学证实的脑血管病变的个案显示,糖皮质激素和环磷酰胺治疗有效。干燥综合征合并神经系统病变亦以糖皮质激素、免疫抑制剂及人免疫球蛋白等治疗为主,但目前尚无大型临床试验研究。
此外,在环磷酰胺治疗SSc相关间质性肺病的临床研究中发现,环磷酰胺的治疗效果与其诱导血管内皮前体细胞(endothelial progenitor cells,EPCs)的活化有关,而并非仅针对血管炎病变。EPCs是一类在新生血管形成中起重要作用的细胞,据报道,EPCs的减少造成了SSc患者血管生成障碍及微循环障碍悼。这可能是环磷酰胺治疗SSc脑动脉受累的另一途径。
综上所述,SSc患者血管受累较为常见,但血管炎并不多见。虽然,血管炎并非SSc的常见表现,但也有一些合并脑血管病或以脑梗塞症状为首发表现的病例。且较多SSc患者存在脑血流减少的亚临床状态,脑血管病表现似乎与周围血管病严重程度平行。
目前,SSc合并脑血管病的病理生理机制尚不明确,可能有血管炎、脑血管痉挛、内皮增生等造成血管病等多种机制参与。临床对于伴有严重周围血管病表现的SSc患者,需注意警惕其脑血管病可能,必要时可行早期头颅影像学筛查。目前尚无明确大规模循证医学证据可针对原发病的糖皮质激素和免疫抑制剂的选择提示依据。