自1990年第一个人类基因治疗试验以来,基因治疗一直在持续[1]。近年来,随着近年来在腺相关病毒(AAV)在B细胞癌、眼癌、肺癌的治疗方面取得成功,基因治疗的方法逐渐在各个器官内得到验证,包括肾脏。
与其他器官相比,肾脏中的转基因疗法受到限制,部分原因是由于我们缺乏促进高效载体如何进入肾脏复杂结构的相关知识。本文将介绍不同血清型AAV,结合组织特异性启动子,在肾脏中高效表达的方法,以及客户应用AAV的成功案例。

(一)血清型选择


利用肾静脉逆行注射技术将AAV5, AAV6, AAV8以及AAV9注入小鼠肾脏,不仅证实肾静脉逆行注射比尾静脉注射有更好的肾基因转导效果,而且发现在四种AAV血清型中,AAV9更能同时高效转导皮质和髓质(AAV6转导髓质效果更好,但对皮质转导效率较低),此外,AAV9均能有效靶向肾小球和近端小管且在肾小球内效率更高[2]。
具体使用病毒参数解析:
实验动物:2月龄C57BL/6小鼠
注射方式:肾静脉注射
注射量:100 µL,5×1010 particles
启动子:CMV

(二)组织特异性启动子

1. 肾小管上皮细胞特异性启动子KSP[3]

2. 足细胞特异性启动子NPHS1

实验动物:18周龄C57BL/6怀孕母鼠
注射方式:尾静脉注射
注射总量:1.0×1012 vg
血清型选择:9型
检测时间:注射后8周

对注射后小鼠肝、肾、脾、脑、心和肺mRNA的cDNA进行荧光定量PCR检测。白色柱状图表示使用NPHS1启动子(rAAV 2/9-NPHS1-eGFP);黑色柱状图表示广谱启动子CMV(rAAV 2/9-CMV-eGFP)[4]。

(三)应用案例

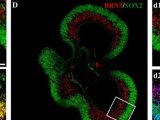
客户应用案例一:B超引导下右肾原位注射
将FGF2敲除AAV注射到小鼠肾脏中然后进行单侧输尿管梗阻手术(UUO)操作,与UUO组和AAV对照病毒组相比,FGF2基因敲除后FGF2、STAT3、p-STAT3和YAP1蛋白水平显著降低,并且纤维化指数下降。免疫荧光、免疫组织化学、H&E染色和Masson染色结果显示与western blot趋势相同[5]。

具体使用病毒参数解析:
实验动物:8-10周龄C57BL/6小鼠
病毒设计:FGF2干扰腺相关病毒AAV9‐FGF2‐RNAi
注射方式:B超引导下右肾原位注射
注射量:0.2ml,稀释至滴度4.521×1011 v.g/ml
血清型:9型
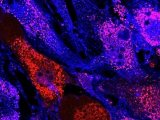
客户应用案例二:肾静脉注射
Smad3基因敲除降低STZ诱导的糖尿病小鼠的急性肾损伤敏感性[6]。
A、示意图说明了动物实验设计;B和C、Smad3的mRNA和蛋白质水平;D、尿白蛋白/肌酐比值;E、肾组织用高碘酸Schiff染色并量化肾小管损伤。

具体使用病毒参数解析:
实验动物:8周龄C57BL/6小鼠
注射方式:肾静脉注射
注射量:100µL,滴度1×1011vg/ml
血清型:9型
启动子:U6

(四)注射方法及参考剂量

由于肾脏生理特性,存在肾小球屏障限制,血液通过传入小动脉进入肾单位的肾小球,传入小动脉直径约为20000nm,滤液会进一步渗透到肾单位受到肾小球基底狭缝横膈膜(直径约为10nm)直径的限制膜[7]。

狭缝的小直径横膈膜限制病毒载体进入肾脏血流, 因此传统的AAV载体全身给药难以在肾脏达到足够的表达水平,即便是高剂量给药也会导致AAV集中在肝脏等肾外器官中,需要其他注射方式突破肾小球屏障直接感染肾脏组织,如肾实质注射、经输尿管逆行注射、经肾实质肾盂注射等。

不同的注射方法感染动物之后基因表达分布及特性不同,所需病毒剂量也有差别,总体来讲利用系统性的注射方式所需病毒剂量较大,原位注射可大大减少病毒剂量,具体如下表所示:
AAV肾脏感染方式 | 基因表达分布 | 特点 | 病毒参考剂量 |
尾静脉注射 | 全身大多数器官均可感染 | 操作简单,病毒消耗量大 | 5E+11~1E+12vg |
肾静脉注射 | 皮质和髓质中表达,主要在肾小球和近端小管中 | 难以突破肾小球屏障,效率较低 | >1E+11vg |
肾动脉注射 | 近端小管和肾集合管 | 技术挑战性强 | / |
肾实质注射 | 仅限于注射针道周围 | 操作相对简单 | 1.5~3ul/位点 |
经输尿管逆行注射 | 肾脏管道系统 | 克服肾小球屏障限制,操作难度大 | >1E11vg |
经肾实质肾盂注射 | 皮质和髓质的肾小管上皮细胞中,主要是集合管细胞 | 新注射方式,操作简单,基因表达稳定 | 约5E10vg |
【参考文献】
[1] Davis L , Park F . Gene therapy research for kidney diseases[J]. Physiological Genomics, 2019, 51(9).
[2] DOI: 10.1038/gt.2014.35
[3] DOI: 10.1172/jci.insight.138183
[4] Wong M A , Cui S Y , Quaggin S E . Identification and characterization of a glomerular-specific promoter from the human nephrin gene[J]. Am J Physiol Renal Physiol, 2000, 279(6):F1027.
[5] Li X , Zhang F , Qu L , et al. Identification of YAP1 as a novel downstream effector of the FGF2/STAT3 pathway in the pathogenesis of renal tubulointerstitial fibrosis[J]. Journal of Cellular Physiology.
[6] Wang J N , Yang Q , Yang C , et al. Smad3 promotes AKI sensitivity in diabetic mice via interaction with p53 and induction of NOX4-dependent ROS production[J]. Redox Biology, 2020, 32.
[7] Rubin J D , Barry M A . Improving Molecular Therapy in the Kidney[J]. Molecular Diagnosis & Therapy, 2020(7).



1.实验技术干货
2.蛋白质组学研究
3.腺病毒简介及应用
6.单细胞测序
8.悬浮细胞专用病毒
10.测序技术研究与应用
12.腺相关病毒选择/应用
13.表观遗传研究
14.文章解析
15.国自然课题设计思路解析
16.生物信息分析及工具
17.外泌体研究
18.肿瘤免疫研究
19.高分文章
20.吉凯病毒神经方向应用案例