蛋白质组学
蛋白质组学是鉴定和定量细胞、组织或生物体蛋白质的科学,目的是了解生物学变化和疾病状态,开发疾病的生物标记和治疗药物的靶点。
如果将一个基础蛋白的各个修饰蛋白算作一个蛋白,那么哺乳动物细胞含多达3~4万个蛋白。当计算各个修饰后的蛋白时,蛋白质的数量远远超过了10万。
细胞内不同蛋白质的丰度或浓度可能因不同的数量级而变化。
细胞系统的任何变化,如老化、患病或接受药物治疗等均会导致一个或多个蛋白质相对丰度或表达发生变化。
蛋白质组学旨在鉴定细胞系统内的蛋白质,并识别和监测蛋白质的变化,如对蛋白质的修饰(翻译后修饰)或蛋白质相对浓度的变化。
如果某一事件使蛋白质丰度增加,那么我们就说该事件上调蛋白表达。如果某一事件使蛋白质丰度降低,那么我们就说该事件下调蛋白表达。
受细胞变化影响时,蛋白质丰度可能会发生显着变化,蛋白质丰度的变化是事件变化的信号。
翻译后修饰(PTM)是指蛋白质在翻译后的化学修饰。
PTM包括寡糖链的添加(糖基化)、醋酸盐等含烷基蛋白质N-端的修饰(乙酰化等)、丝氨酸、苏氨酸或酪氨酸上磷酸基团的加入(磷酸化)等相似活动。
磷酸化等PTM活动在很大程度上是临时性的,用于细胞在细胞内和细胞间信息的传递。
糖基化等PTM活动为结构性改变,通常影响蛋白质折叠、与其他分子的相互作用以及与细胞壁的相互作用。
所有这些代表了活细胞内发生的动态变化。

蛋白质组表示细胞内或任何研究样品中全部的蛋白质。
一个完整的细胞蛋白质组由40000种单个蛋白质组成,具有多达10~20种不同的修饰形式,丰度也因数量级的不同而变化。
蛋白质组学的目标显然是巨大的,要求最强大的分离和分析技术。
电泳A
为了实现蛋白质的鉴定和/或定量,必须尽可能地将单个蛋白质与其它蛋白质分离。
很多年来,凝胶电泳法均为分离完整蛋白质的初级手段。
双向凝胶电泳(2DGE)根据蛋白质的等电点(第一向)和分子量(第二向)实现蛋白质的分离(见图48)。
完整细胞蛋白质组的2DGE相当复杂,且在分离多达2000~3000个蛋白质的同时,很难实现蛋白质间的相互分离,或由于某些蛋白质丰度低而很难在凝胶上看到。2DGE仍是强大的蛋白质分离工具,它是一项发展成熟的技术,具有许多经验丰富的用户,能够实现高分辨率和多种蛋白质的定量。
目前,2DGE的局限性是其不仅耗时而且费力,主要衡量丰度更高的蛋白质,较难实现膜结合蛋白等重要蛋白质的衡量。
图48. 双向凝胶电泳可分离出多达2000~3000种单个蛋白质。
每一个斑点代表一个或多个蛋白质。
横向分离由等电点引起,与电荷有关。
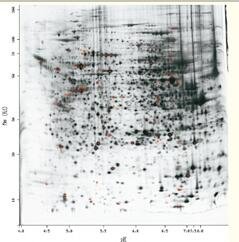
纵向分离由分子量大小引起(SDSPAGE)。
分子量较小的蛋白质移到凝胶底部,而分子量较大的蛋白质留在凝胶顶部。
