柱内径
由于样品容量很低,纯化过程很少使用小孔柱(内径小于2mm)。
小规模实验室纯化采用细孔柱(内径约2mm)和分析柱(4.6 mm内径)。
这种小规模制备分离的色谱条件通常与分析分离的色谱条件相同。
需要大量蛋白质/多肽时,采用10mm和22mm内径的柱子。
1 mg蛋白质或多肽的纯化可采用10 mm柱子,5 mg纯化可采用22 mm柱子。
允许柱过载时,可纯化更多蛋白质/多肽,10mm柱最多可纯化50mg,22mm柱最多可纯化200mg。
大量蛋白质或多肽的纯化采用50 mm、100 mm或内径更大的大内径柱子。
50mm内径的柱上已知最多可纯化5克蛋白质/多肽。
柱长
与分析柱相比,制备柱往往相对较短。
这是因为在制备色谱法中,柱的总体积比柱长更重要,特别是蛋白质的分离。
内径60cm、柱长12-15 cm(“圆饼状”柱)的色谱柱已应用到蛋白质治疗药物的大规模纯化中。
由于在制备色谱法中,柱通常过载,且效益的重要性远不及产量、纯度及通量重要,因此根据其实用性而非效益优化柱尺寸。
流动相组成
同分析色谱法一样,采用10~22mm内径柱的小规模纯化常用乙腈-TFA体系。
大规模纯化通常采用乙醇等溶剂替代乙腈,采用乙酸替代TFA。
尽管采用这些溶剂作流动相会降低分辨率,但它们更适合大规模使用,且分辨率的降低与柱过载固有的分辨率损失相同
蛋白质变性
通常认为反相色谱法会使蛋白质变性,因此洗脱出来的蛋白质不是天然蛋白,且可能不具备生物活性。
尽管反相HPLC的操作条件会使蛋白质变性,但洗脱后仍可获得天然、具有生物活性的蛋白质。
有机溶剂可能减弱疏水力,造成蛋白质三级结构的损失。吸附剂的疏水面也可能导致蛋白质的去折叠。
但与色谱分离时间相比,蛋白质去折叠通常较慢,且蛋白质在反相色谱分离期间仅发生轻微变性。
由于二硫键的作用,蛋白质保持球形结构,且仅发生部分去折叠,因此从反相柱洗脱出的蛋白质通常可通过在恰当的重折叠缓冲液中处理,从而恢复其天然结构而恢复至天然状态。
目前有许多实例均显示采用反相HPLC纯化后的蛋白仍维持天然三级结构和生物活性。
胰蛋白酶的反相纯化,其中活性得到了保留,且随后用于蛋白质的胰蛋白酶酶切。
重组人红细胞生成素是一种成功商业化的蛋白质治疗药物,采用了反相高效液相色谱法将蛋白药物从其细胞培养表达系统中分离出来。
采用反相HPLC对另一种商业蛋白质治疗药物——粒细胞刺激因子进行了纯化。
此外,还采用反相HPLC对重组人胰岛素进行了纯化,维持了活性结构。
纯化实例
图47显示了合成肽——促性腺激素释放激素(GnRH)拮抗剂的纯化过程。该纯化过程通过以下几个步骤展开:
在4.6 x 250 mm 的分析柱上构建洗脱条件。
在50 x 300 mm 的柱上装载1.2克合成肽混合物,基于第一步构建的条件洗脱(图47)。
对 GnRH 拮抗剂各洗脱峰的片段进行收集并借助分析法分析,最终实现最高产量和纯度。
用乙腈和TFA作为洗脱剂,在反相色谱柱上再次进行色谱分析,完成收集到片段的脱盐处理。
收集片段实现最高产量和纯度。
在该色谱纯化步骤中,从1.2 gm的反应混合液中可收集128 mg的纯化肽。
该纯化过程采用了与分析色谱分离相同的有机溶剂——乙腈,但采用磷酸三乙胺替代了TFA。
由于柱过载,洗脱峰更宽,分辨率不如分析色谱。但峰仍然较为紧密,且容易收集到含目的多肽和GnRH的洗脱液。
图47. 128mg的合成肽——促性腺激素释放激素的纯化。
柱严重过载,导致峰非常宽。
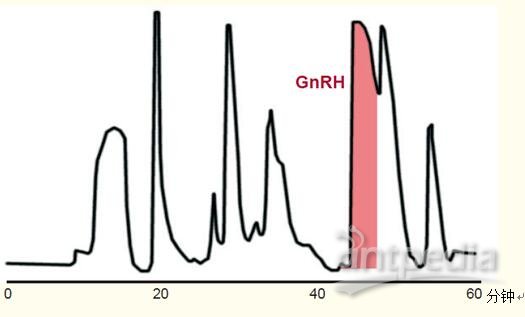
条件
色谱柱:C18宽孔柱,15~20μm粒径,50 x 300 mm。
流动相:乙腈和磷酸三乙胺水溶液梯度洗脱。
样品:促性腺激素释放激素
