摘要:
Vogelstein和Kinzler(美国国家科学院院刊,1999年)第一次描述了Digital PCR(dPCR)的概念,一种在微量细胞群中(如原发性肿瘤组织)鉴定突变的方法。通过稀释样品DNA到一个单个分子水平,它可以把PCR自然模拟指数转化为数字信号。当PCR成功的扩增出这些单个分子,产物可以通过对观察到的预期的体细胞纯合突变峰进行测序分析,而不是典型测序反应中的被遮盖在背景杂峰中的少量低峰。通过扩增足够多的单个分子的扩增产物, 基于观察到的突变体与全部的成功扩增产物的比,微量突变体可以被鉴定出。
方法:
我们采用一种加入HRM使用的改良dPCR方法,通过特殊的HRM曲线图在原发性肿瘤样本中发现低含量的突变部分。
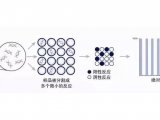
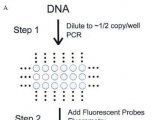
数字PCR要求以单个DNA分子作为扩增模板,从而使末端检测变为数字读出而不是模拟的DNA混合物。为了应用HRM,需要获得更多的扩增产物,来得到更加可靠的HRM曲线图组,因此我们选择了五不同的稀释浓度。
这些稀释样本是基于后续的灵敏度接近于20%的测序手段去检测微量突变体. HRM表现出高敏感性,下至2-5%的突变体都可被检出。因此,一个单一突变基因的复制足以在溶解曲线图中发现他们的差异.
检测14种不同癌症基因,17个样本表现出存在可能的微量突变体(12)或已知突变(5)。(见表1)

对于已知突变的样本,建立了含有5%,2.5%和1.25%的微量等位基因的混合物。所有的样本都进行了目标浓度为5,10,20和40份拷贝的稀释,扩增循环数24。
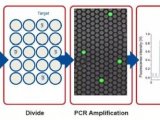
在高分辨率熔解曲线分析中排除没有理想扩增产物的样品。挑选出显示可能有突变的稀释样品进行测序。图1 说明了这种dPCR方法中应用HRM的工作流程。

结果:
12个肿瘤样本中的9个被确定存在微量突变体。而所有的5个已知突变的样本全部成功的在1.25%稀释浓度下被鉴定出来。图2说明了“有效”的浓度可以通过应用表2的概率估计。

在5份拷贝这个稀释度中存在6个扩增失败,建议有效地稀释浓度接近1-1.5倍(3-4.5pg)。

图3和图4是一个例子,来演示如何在同一个样本上运用多重稀释,以确定理想的稀释浓度来鉴定微量突变体


图5a和5b显示已知的BRAFx15突变分别稀释在20和40的拷贝数。等位基因分数反映,测序方法与稀释度很好的对应起来。

结论:
这些结果显示了与传统dPCR相比,如何利用HRM预检改良dPCR方法,显著的降低后续测序阶段的工作来发现微量突变体。
在这项研究中,鉴定候选的HRM曲线比传统的所有模板重测序的方法减少了90%的工作量。