超多重PCR技术简介
1.1 PCR及多重PCR技术
1.1.1 PCR技术
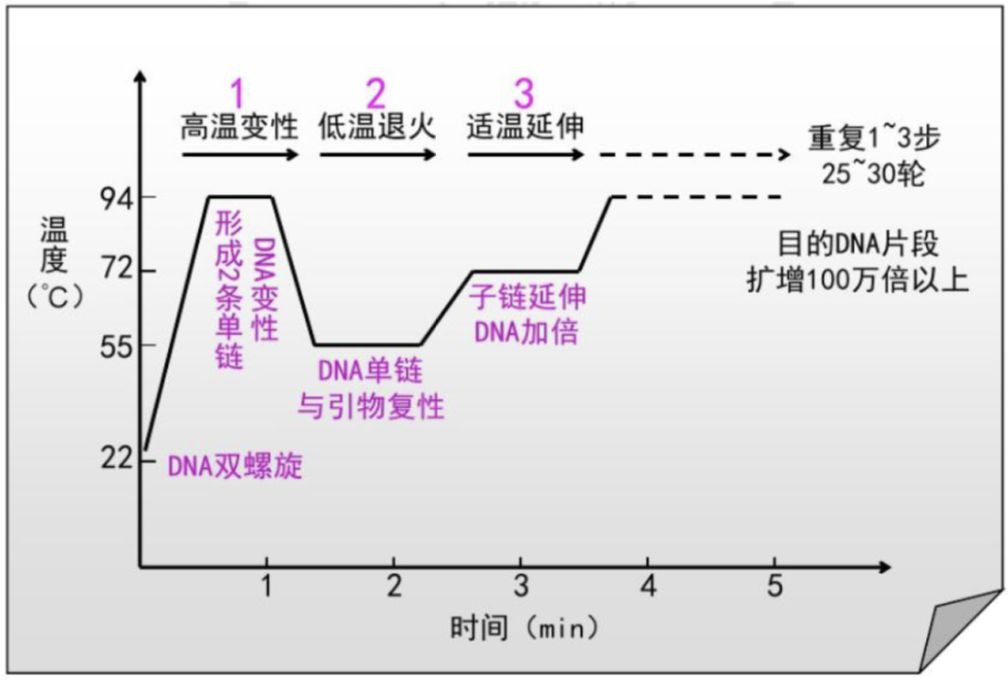
聚合酶链式反应(PCR)是一种在体外是用已知寡核苷酸引物引导未知片段中微量待测基因片段进行扩增的技术。PCR反应体系主要包括待扩增样品模版、特异性引物、DNA聚合酶(polymerase)、扩增底物dNTPs以及含有Mg2+的反应缓冲液几部分,通过高温变性(DNA解聚为单链)、退火(特异性引物结合与模板)、延伸(在DNA聚合酶作用下从5’向3’端进行模板互补配对延伸)等步骤,对模板上引物范围内的DNA片段实现指数级扩增。PCR技术于1985年发明,由于该技术对现代分子生物学的建立起到至关重要的作用,发明人穆勒获得了1993年诺贝尔化学奖。由于PCR技术能够在短时间内获得大量DNA片段,灵敏度高、特异性强,因而广泛应用于病原微生物、遗传病相关基因、肿瘤相关基因、优生优育等领域的检测。
图1.PCR流程示意图(来源:中国仪器网)
1.1.2 多重PCR技术
PCR产生以来,以常规 PCR 为基础衍生出一系列新的 PCR 检测技术。多重PCR(multiplex PCR, mPCR)顾名思义,是在一个反应体系中进行两种及以上PCR片段特异性扩增的技术,由Chambehian于1988年提出,其反应原理、操作过程及仪器均与常规PCR相同,优势在于可以对不同的模板实现一次性同时扩增,检测通量有所提升,同时在引入定量内参的情况下,还可指征模板的数量情况。
对于PCR扩增产物进行结果分析的传统方式有限制性内切酶消化鉴定、基于电泳的方法,包括琼脂糖凝胶电泳、微流控毛细管电泳、聚丙酰胺凝胶电泳等。对PCR产物进行电泳,由于DNA片段整体带负电荷,在电场作用下会在电泳仪内向正极迁移,迁移速率受PCR扩增片段大小的影响。故可将大小不同的PCR产物在电泳过程中分开。该方法快速且成本较低,但由于通过片段大小判断PCR过程中是否发生特异性扩增,因此引物设计在考虑特异性的同时,不同扩增片段的长度差异需高于电泳的分辨率。因此这一检测手段的分辨率从源头上限制了多重PCR中可以最大同步扩增的产物数量。
伴随着测序技术,尤其是NGS技术的发展,对PCR产物进行高灵敏度及高分辨率的检测成为了可能,因此多重PCR可同步扩增的片段数量上限演变为多重PCR自身体系的限制。不同于传统仅仅进行4-5重,至多30重的PCR反应体系,上千重甚至上万重的超多重PCR(high-multiplex PCR或ultrahigh-multiplex PCR)的实现辅以NGS测序,形成的靶向-NGS(tNGS)技术已逐渐在遗传病诊断、肿瘤基因检测等领域发挥作用。
1.2 超多重PCR技术要点简介
超多重PCR的难点在于,若想在一个体系中实现上百、上千甚至上万个片段的特异性扩增,并非简单将引物混合扩增即可。不同引物的特异性、不同扩增片段本身的特异性及扩增条件均为需要综合考虑的内容。设计超多重PCR时,至少需要综合考虑以下几点因素:
1. 目的基因片段的选择:需要扩增的目的基因片段需要具有足够的特异性,否则容易在退火阶段出现不同基因片段之间的非特异性配对,导至PCR效率降低。
2. 引物设计:特异性,即多对引物之间不能互补,尤其需要避免3’端互补;长度,引物需要具有一定的长度实现其特异性,但较长的引物会更容易引起引物二聚体形成,降低引物有效浓度;退火温度,引物Tm值需要相对高一些以提高退火温度,在后续mPCR中选用最低退火温度以增加扩增特异性。
3. 反应体系:反应体系中各组分需满足每队引物对应靶点扩增量的需求。比如dNTP能够结合Mg2+,但DNA聚合酶发挥活性有赖于游离的Mg2+,因此dNTP和Mg2+的浓度需要有所平衡;DNA聚合酶含量过低造成扩增产物的降低,含量过高容易导至不同浓度模板的不均匀扩增以及背景扩增升高等问题。
由此可见,超多重PCR希望实现较好的扩增性能,需要综合考虑反应多方条件,具有极高的技术壁垒,目前全球真正掌握该技术的公司数量屈指可数。