引言
在人类神经系统疾病的发病机制中,神经系统发育和退化过程中的突触形成是一个高度受控的过程。复杂神经元网络环境的细微变化可能会破坏或产生突触联系。监测神经元功能的稳健、自动化、定量体外检测将有利于神经系统疾病的药物发现筛选和复合神经毒性评价。我们假设(1)对神经系统的毒性损伤在神经毒性早期会导致神经突触退化,如果损伤严重,最终会导致神经突起变性和神经细胞元死亡;(2)突触形成和神经元形态的体外功能检测可用于监测和识别此类神经毒性事件。因此,我们开发了一种自动化、功能性、高内涵的筛选成像检测,以跟踪和量化神经突形态和突触的动态变化。该检测通过神经元特异性标记物识别原代神经元细胞,并通过突触前和突触后标记物检测神经突棘上的突触。包括核标记物在内的多重靶标可通过四种荧光颜色同时检测,并使用自动成像仪器采集标记神经元和突触的荧光图像。通过专门的图像分析软件,神经元形态和突触的表型特征可实现自动识别和即时定量。这些特征是神经元发育、分化和神经毒性的潜在指标,可在不同条件和不同药物治疗下对特征变化进行定量。通过监测这些特征的变化,我们还可以对参与发育神经毒性的化合物进行定量评价。总之,该检测有利于复杂药物发现筛选和复合神经毒性评估过程的自动化和精简化;并能够在神经元形态和功能方面(特别是神经突和突触相关事件)对化合物进行定量比较。
摘要
中枢和外周神经系统中的神经元负责不同位置之间的电信号传送,以维持大脑和身体的正常功能。而突触作为神经细胞和接收神经元脉冲的细胞之间的连接点,则是神经元中维持正常功能网络的关键结构之一。这些突触之间的分子网络不仅控制突触信号传递和突触可塑性,还负责调节神经元的生长、分化和死亡。已对突触连接的微观结构进行了广泛研究,以了解突触活动与神经病理生理学之间的关系,以及参与突触形成和突触调节的分子机制。
突触功能在受到天然或人造神经毒性物质破坏后,可能会导致长期且通常不可逆的神经元损伤。突触损伤通常被认为是许多不同病理条件下神经退行性变的首发体征,包括创伤性神经损伤、缺血性卒中和许多神经退行性疾病,如运动神经元病、阿尔茨海默病、帕金森病和亨廷顿病。许多突触蛋白在神经退行性疾病的进展中发挥重要作用。例如,β淀粉样前体蛋白和早老蛋白、α-突触核蛋白、亨廷顿蛋白、失调症蛋白1、Frataxin蛋白和朊蛋白均参与神经元突触前或突触后结构,并在突触损伤和神经变性中发挥作用。
为了测量突触形成或突触损伤中发生的突触变化,需要开发一种可靠、准确且有效的方法,以便对突触丢失、神经突变化和神经元死亡进行准确测量。本指南介绍了一种利用自动化、定量、高内涵细胞成像和分析技术测量突触功能的新方法。将Thermo Scientific突触发生HCS检测试剂与Thermo Scientific CellInsight高内涵筛选(HCS)平台和神经元谱分析生物应用(Neuronal Profiling BioApplication)结合使用,可在体外进行神经元形态和突触定量测定。神经元谱分析生物应用是CellInsight HCS平台的自动图像分析软件模块,其可在自动图像采集时进行即时自动图像分析和定量。利用这项技术和检测方法,我们可以识别突触随时间的变化,并以自动化方式测量突触和神经突参数。
突触发生检测候选靶标
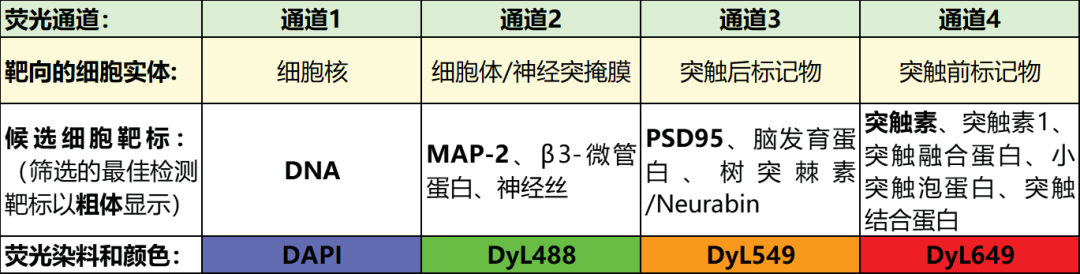
表1:可通过四种不同颜色检测潜在的突触发生HCS检测靶标。
Thermo Scientific HCS平台可将所有细胞分析步骤无缝整合

突触前标记物、突触素、全细胞染料和MAP-2

图1-A
● 小鼠皮质神经元18 DIV
● Thermo Scientific全细胞染料(红色)
● 突触素(绿色)
● 在CellInsight 高内涵平台上成像

图1-B
● 大鼠海马神经元22 DIV
● Map-2(绿色)
● 突触素(红色)
● 在CellInsight 高内涵平台上成像
图1:A.突触素是一种良好的突触前标记物。DAPI和全细胞染料分别用于检测细胞核和神经突的精细结构(小鼠皮质神经元,18DIV)。
B.突触素和MAP-2染色用于检测突触前囊泡和神经突(大鼠海马神经元,22DIV)。
使用Thermo Scientific神经元谱分析自动测量突触前囊泡和神经突

原始图像
突触前标记物突触素
(红色)
神经元标记物MAP-2
(绿色)
分析图像
分支点(白色)
定位突触素(紫色)
神经元轨迹(蓝色)
图2:对小鼠皮质神经元(14 DIV)进行突触素(红色)和MAP-2(绿色)染色(左图),并使用CellInsight高内涵平台和神经元谱分析生物应用进行分析(右图)。
突触前囊泡、突触后结构和神经突的自动同步测量

原始图像
突触前标记物突触素
(红色)
神经元标记物MAP-2
(绿色)
分析图像
分支点(白色)
定位突触素(紫色)
神经元轨迹(蓝色)
图3:对大鼠海马神经元(21DIV)进行突触素、PSD-95和MAP-2染色,然后成像并进行分析。
左图:通过MAP-2染色检测神经突。右图:通过PSD-95染色检测突触后标记物点(品红色点),并通过突触素点进行共定位(绿色点)。共定位点(绿色)代表潜在突触的位置。
点状PSD-95染料随神经元成熟而增加
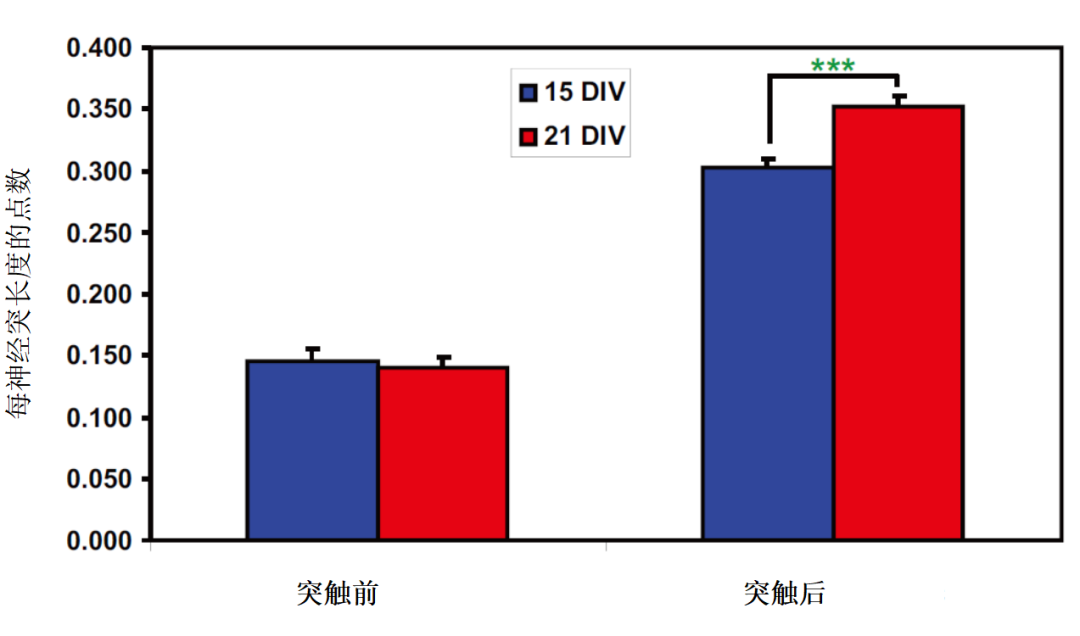
图4:对小鼠皮质神经元进行15 DIV或21 DIV培养并使用突触素、PSD-95和MAP-2染色,然后成像并进行分析。与15DIV神经元相比,21 DIV神经元中只有经PSD-95抗体染色的突触后点增加(Student t检验,p < 0.001)。突触前点无显著变化。
神经突和突触变化作为对药物治疗的神经毒性反应

图5:对小鼠、大鼠皮质或海马原代神经元进行21 DIV培养21,并研究药物对这些神经元不同特性的剂量依赖性反应。(A)使用HBSS中含有10 mM甘氨酸的谷氨酸处理30分钟,然后洗涤并用培养基替换。
孵育24小时后,对神经元进行固定、染色和分析。将(B)红藻氨酸、(C)H2O2、(D)锌、(E)U0126在培养基中处理24小时。(Student t检验,*p < 0.05,**p < 0.01,***p < 0.001)。
神经突和突触变化作为对Aβ1-42聚集体的神经毒性反应

图6:对大鼠海马原代神经元进行50 DIV培养。研究Aβ1-42聚集体的剂量依赖性反应。在37°C下将500 mM Aβ1-42在培养基中孵育3天以诱导寡聚化。将神经元与Aβ1-42寡聚体孵育48小时,然后进行固定、染色和分析。Aβ1-42毒性导致突触丢失。(Student t检验,*p < 0.05,**p < 0.01,***p < 0.001)。
总结
多参数突触发生检测能够同时对神经突、突触前和突触后结构以及突触进行自动识别和量化分析。
● 准确检测神经毒性。
● 特异性检测影响突触的物质。
● 该检测方法适用于急性或慢性神经退行性疾病的细胞模型。
本研究方案为赛默飞研发科学家独立完成。
即刻扫码,申请免费试用,联系您身边的高内涵专家