原发性颅内神经母细胞瘤属于极为少见的高度恶性颅内肿瘤,可发生于儿童,成年患者罕见。2011年5月南京军区福州总医院神经外科收治1例成人颅内神经母细胞瘤患者,术后无瘤生存至今。现对该患者的临床资料进行分析,并结合文献探讨颅内神经母细胞瘤的临床、影像及组织病理学特点,以及治疗策略和预后。
1.临床资料
患者男,25岁。因“头痛、视力下降伴右侧肢体麻木1个月”于2011年5月2日入院。神经系统查体:眼底可见双侧视乳头水肿,未见明显定位体征。头颅MRI平扫+增强扫描示,左侧额叶见巨大囊实性占位,大小约6.6 cm×6.0 em×5.5 cm;实性部分T1WI呈低信号,T2WI呈稍高信号,弥散加权成像(DWI)呈高信号;囊性部分T1WI、DWI及水抑制像呈高信号;占位效应较明显,左侧脑室呈受压,中线结构稍向右移位;增强扫描实性部分呈明显强化,囊性部分未见明显强化(图1A)。病灶区MRS:代谢物波谱图主要显示NAA、Cr、Cho峰,病灶区NAA峰明显下降,Cho峰明显上升。
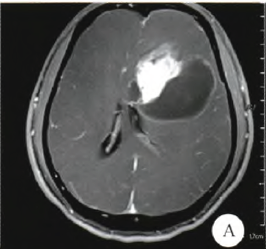
图1A 术前轴位增强扫描,肿瘤为囊实性,实质部分显著强化
术前诊断:左侧额叶胶质母细胞瘤。行神经导航下开颅左侧额叶肿瘤切除术。术中见肿瘤呈囊实性改变,实质部分质地较韧,血供丰富,与周围脑组织分界较清,显微镜下完全切除肿瘤。术后患者无神经功能缺失症状;复查头颅MRI未见肿瘤残余(图1B);病理及免疫组化检查诊断:颅内神经母细胞瘤(WHO IV级),见图2。
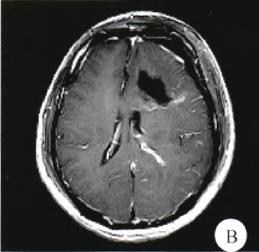
图1B 头颅MRI。术后1周复查,肿瘤全切除
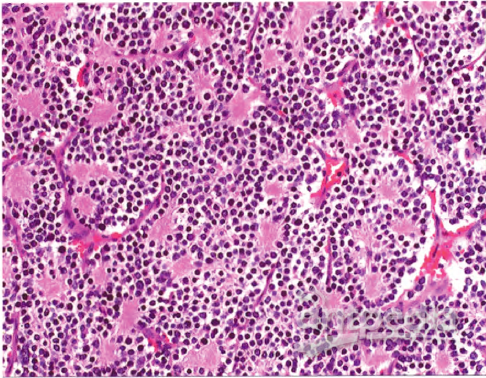
图2 瘤标本病理检查.细胞核分裂多见,可见特征性神经毡结构及Homer-Wright菊形团(HE染色)
予以替莫唑胺同步放、化疗,具体方案:放疗的整个过程应用同步化疗,口服替莫唑胺75 mg/m2,连服42 d,放疗过程中不接受放射治疗日亦按相同剂量服药。放疗结束后4周,辅助替莫唑胺治疗,具体方法:150 mg/m2,连服5 d,28 d为一个疗程,共6个疗程。随访患者2年,未见肿瘤复发(图1C)。
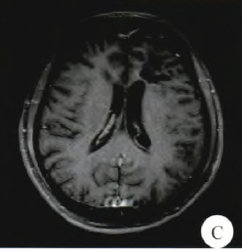
图1C 头颅MRI。术后第3年复查,未见肿瘤复发
2.讨论
2.1 神经母细胞瘤分型与发病机制
神经母细胞瘤分为外周型和中枢型两种,在世界范围内发生率均低,白种人相对多发,而非洲人及亚洲人中少见;由于其起源于干细胞突变,因此患者的发病年龄较轻。外周型神经母细胞瘤是起源于外周交感神经系统的胚胎神经嵴细胞的恶性肿瘤,有恶性程度高、进展快、易发生转移、发现时多为晚期、预后差等特点。
WHO(2007年版)中枢神经系统肿瘤分类将颅内神经母细胞瘤归为中枢系统原始神经外胚层肿瘤(CNS PNET)的一个亚型。因原始神经外胚层有多分化潜能,当具有神经元分化时,称为神经母细胞瘤。原发于中枢神经系统的颅内神经母细胞瘤少见,有报道者主要以个案为主。有研究表明颅内神经母细胞瘤的发生与染色体移位有关,在对患者基因检测过程中发现患者多有染色体移位:t(11;22)(q24;q12)。有学者提出,甲基化导致抑癌基因DLC-1的失活与幕上神经外胚层肿瘤的发生有关,相应的基因水平检测可能提高患者肿瘤性质的诊断率。
2.2临床表现
根据肿瘤发生部位不同,颅内神经母细胞瘤的临床症状也不同,通过复习文献,肿瘤的发生部位多位于幕上大脑半球,原发于幕下的神经母细胞瘤仅见1例报道。幕上神经母细胞瘤可发生于脑实质、硬脑膜、侧脑室及松果体、鞍区。原发于鞍区者,以进行性视力障碍、双颞侧视野偏盲及动眼神经功能障碍为主,伴有内分泌激素分泌异常。原发于眶内者,以眼球突出、视力下降等为特点。本例患者的肿瘤位于左侧额叶,以颅高压症状为主。
2.3诊断与鉴别诊断
神经母细胞瘤术前诊断比较困难,确诊需依据病理检查结果。组织病理学上,分化型和分化差型神经母细胞瘤可见特征性神经毡结构,核分裂多见,可见Homer-Wright菊形团,纤维组织增生、坏死,瘤细胞向周围脑组织浸润性生长,不易误诊;而未分化型在显微镜下呈一致的小圆蓝细胞,与其他小圆蓝细胞鉴别诊断主要依靠免疫组织化学染色。神经母细胞瘤具有合成和分泌儿茶酚胺能力,故测血及尿香草扁桃酸(anillylmandelie acid,VMA)含量增高有助于诊断。
术前影像学诊断有一定困难,通过复习文献,该肿瘤具有一定的影像学共性特点:肿瘤体积较大,多位于大脑半球,占位效应明显;肿瘤易发生坏死、囊变、钙化及出血,与周围脑组织分界多较清楚;瘤周水肿相对较轻或无;MRI平扫T1WI呈等或稍低信号,T2WI呈等或稍高信号,增强扫描后明显强化。本例患者的MRI诊断考虑为胶质母细胞瘤,误诊的原因除了对本病认识不足外,主要因为颅内神经母细胞瘤无特征性的影像学表现。故其易与好发部位常见肿瘤混淆,如脑实质内间变性星形细胞瘤、室管膜瘤、多形胶质母细胞瘤、脑膜瘤等。
复习文献,颅内神经母细胞瘤MRI影像表现主要与以下肿瘤鉴别:
(1)间变性星形细胞瘤:间变性星型细胞瘤呈浸润性生长,边界不清,血管增多及坏死缺如,MRI平扫示病灶T1WI为边界不清低或混杂信号,T2WI呈混杂信号,增强扫描无强化或局部强化,钙化少见,而颅内神经母细胞瘤属于低分化高度恶性肿瘤,强化明显,可见钙化及囊变。
(2)室管膜瘤:幕上室管膜瘤多见于成人,约70%以上完全位于脑室外,多位于脑室旁或部分侵犯脑室,MRI平扫示T1WI呈等或低信号,T2WI呈等或稍高信号,可有出血、囊变及钙化表现,增强扫描实性部分明显强化。
(3)多形性胶质母细胞瘤:两者均可坏死、囊变及出血,增强扫描均可见环状强化,故两者鉴别较困难,但神经母细胞瘤较胶质母细胞瘤的发病年龄轻,瘤周水肿较胶质母细胞瘤轻,钙化较胶质母细胞瘤多见。
(4)脑膜瘤:部分脑表面的神经母细胞瘤与脑膜瘤表现相似,均可见钙化,且均可明显强化;但脑膜瘤为脑外肿瘤,好发于中老年人,多可见典型的脑膜尾征,而神经母细胞瘤为脑内肿瘤,发病年龄较轻,且囊变及出血较脑膜瘤常见,邻近颅骨多为溶骨性改变,而脑膜瘤的邻近颅骨可伴有骨质增生,单纯的溶骨性改变较少见,DWI及表观弥散系数(ADC)值也有助于两者的鉴别。
2.4治疗及预后
大量文献报道完全切除肿瘤对于延长患者的生命至关重要。因此对于早期确诊的神经母细胞瘤患者,应尽可能利用一切现有先进技术手段完全切除肿瘤。本例患者由于肿瘤未与脑室沟通,在神经导航和显微镜下予以完全切除;术后采用了全脑放射治疗,并同时给予替莫唑胺同步化疗,随后又进行了6周期的替莫唑胺化疗;随访至今已经接近4年,患者的生活质量良好,无肿瘤复发;长期跟踪随访仍在继续。神经母细胞瘤对放疗敏感,术后残留可行辅助放疗。对于原发的颅内神经母细胞瘤的术后放疗,目前仍未达成共识,多数研究者建议对成年患者进行全脑放射治疗,有些则认为需要全脑及全脊髓放射治疗,因为该肿瘤有很高的脊髓种植率。
此外,还有文献报道贝伐单抗治疗对神经母细胞瘤具有一定的积极意义。多数文献报道,颅内神经母细胞瘤患者术后即使常规进行放化疗,平均生存时间也仅为14个月,与颅外神经母细胞瘤相似(12个月)。但是也有例外,1999年Takaishi等报道了1例大脑神经母胞瘤患者术后正常生活8年,是所有文献报道中生存最长的病例。该患者为10岁的儿童,仅仅做了肿瘤的完全切除,因其父母拒绝放化疗而回学校上学,复发之前生活质量好,已经进入大学学习。因此,颅内神经母细胞瘤的预后并不一定象传统文献报道的那么悲观,最大程度的手术切除以及合理的放疗化疗能够延长患者的无瘤生存时间。