上一期小林专栏,我们对数据可靠性的相关背景知识进行了简略的梳理,本期我们就数据如何满足相关法规要求进一步讨论。
在上一期文章发布之后,有人问我:“根据数据可靠性的相关定义,并没有具体规定只有电子数据记录才能合规,那是不是意味着纸质记录也能满足数据可靠性的相关要求呢?”
单从数据可靠性的定义来讲,相关规范条款确实同时适用于纸质记录和电子记录。美国FDA 21 CFR Part 11 和 欧盟GMP Annex 11明确提到,电子数据记录必须满足该法规要求,才能等同于纸质记录。那么问题来了:为什么我们现在大力推广电子记录的同时加速淘汰纸质记录呢?

一方面,随着经济的发展,制药行业从业人员在不断的迎检过程中逐步积累丰富的应对经验,同时在相关审计机构居高不下的检查频次下,纸质记录的可信度还剩下多少呢?面对电子记录的汹涌浪潮,纸质记录的优势还剩几许?便于记录?便于审核?我想很多老师脑海中第一反应应该是便于修改,便于删除和补充吧!

另一方面,随着科学技术的进步,电子记录和计算机化系统以其严密的权限管理和审计追踪为可能产生的数据作假带来极高的技术壁垒。同时,通过电子记录和计算机化系统也可以大幅降低和避免由于人为操作和记录产生的错误和失误,这也是目前计算机化系统推广的如火如荼的原因之一。没有条件的企业至少也会给仪器设备配置打印机应应景。
对于纸质记录逐步被电子数据替代而言,这是时代进步的必然结果,也是其告别舞台的最后时机。
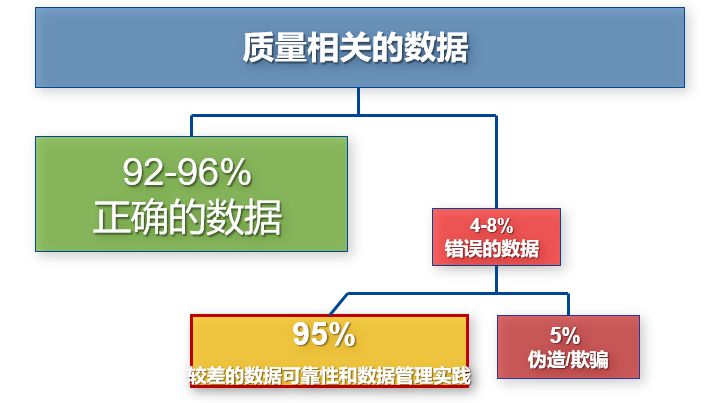
图1 造成错误数据的原因分析
话题转回来,既然现在数据可靠性的话题如此火热,那么我们如何去评估数据可靠性呢?很多老师可能会脱口而出“ALCOA原则”、“ALCOA+原则(暨CCEA原则)”。没错,就是这两大原则了。
2018年1月国家药品监督管理局食品药品审核查验中心公布的《药品数据管理规范》第三版征求意见稿第四章提到药品数据基本要求:数据归属至人、数据清晰可溯、数据同步记录、数据原始一致、数据正确真实等五方面,就是对"ALCOA原则"的诠释,下面我们看看每一项的相关含义。
ALCOA 原则

Attributable归属至人意味着我们可以根据记录中的签名溯源至数据的创建者,修改人员以及其他操作人员,在计算机化系统中此项也意味着通过电子签名进行流程的把控和不同用户账号的唯一性。
Legible清晰可溯意味着在规定的数据保存期限内,数据应该清晰、可读、易懂、可追溯,即使当事人不在场,审计人员通过相应的记录也能再现当时的数据情境,在计算机化系统中此项也意味着审计追踪功能,根据《药品数据管理规范》第三版征求意见稿第五章第三十五条规定,审计追踪功能至少包括以下内容:
(一)操作者、操作时间、操作过程、数据变更的操作原因;
(二)数据的产生、修改、删除、再处理、重新命名、转移;
(三)对计算机化系统的设置、配置、参数及时间戳的变更或修改。
Contemporaneous同步记录顾名思义,意味着数据产生时,要保证数据及时创建并且不被篡改、删除或覆盖,在计算机化系统中此项意味着系统的时间和日期同步并且无法被篡改。
Original原始一致意味着原始数据至少要经过审核且按照规定的期限进行保存,同时在数据的整个生命周期内(从创建到处理再到复核,报告和使用又到存档和恢复乃至销毁)应当容易获得和读取,在计算机化系统中此项也意味着电子记录必须经过审核且有相应审计追踪记录,同时电子数据的归档应确保安全并能重现,最后数据的销毁也必须经过审批。
Accurate准确真实意味着数据能正确、真实、有效、可靠地体现数据所记录的活动,它并不意味着我们所有的数据必须没有错误,而是对异常值、偏差、超标结果等经过调查并建立完善的工作流程减少差错的发生即可,在计算机化系统中此项也意味着产生数据的设备应经过校准、确认和维护,相应的计算机化系统也要经过验证,涉及到的分析方法,工艺等也应经过验证或确认。
CCEA原则

而作为对“ALCOA原则”进行补充的“CCEA原则”,其中,Complete全面性意味着数据必须包含样品测试、重复或重新分析等相关数据在内的所有数据。
Consistent一致性意味着数据是完全按照事件发生的顺序依次记录下来的,比如在HPLC(高效液相色谱)分析的样品数据记录,首先应该是测试样品的质量,然后才有HPLC的分析图谱等。
Enduring持久性强调的是不应使用废纸或者便签做记录,确保在规定的留档期内,数据都被完好保存。
Available可用性比较好理解,指的是数据在生命周期内可随时用于回顾、审计或检查。
ALCOA+CCEA原则不仅是GMP对数据记录可靠性的要求,也是所有符合性审核对数据记录可靠性的基本要求。通过上述详细解析可以发现,ALCOA+CCEA原则实际上就是对记录生成/录入、修改、存储、检索、备份、恢复乃至销毁等数据生命周期内的所有操作的要求。如果这些操作满足了以上原则,那么我们就可以自豪地说一声:“我的数据肯定是符合数据可靠性的!”
本期主要讨论了如何评估数据可靠性,当前满足数据可靠性的相关要求的同时我们总是避不开计算机化系统,所以下一期我们将就计算机化系统确认和验证过程中的注意事项和相关问题进行讨论,欢迎留言哦~