抗体偶联药物(ADC)是一类新兴的生物治疗药物,由抗体、连接子和小分子细胞毒素三部分组成。与传统抗体药物相比,结构会更加复杂,其复杂程度受抗体种类、偶联方式、连接子与毒素种类等多个因素影响。因此ADC分析方法的建立具有特殊性,分析方法很难做到完全平台化,需要根据每类ADC的自身质量属性的特点进行差异化开发。随着越来越多复杂形式ADC分子的出现,如何合理且准确地看到ADC特有的各类质量属性将是未来的难点和挑战。本文就ADC分析与表征的基础技术做简要介绍探讨。
ADC产品关键质量属性(Critical Quality Attributes, CQA)举例如下图所示。根据先验知识和平台经验,与分子安全性和有效性相关的物理、化学、生物或微生物性质及特征,均可纳入关键质量属性,且需随产品开发阶段的进步而不断加深研究。ADC主要的关键质量属性包括一级结构、高级结构、纯度与杂质、载药量与药物分布(Drug-to-Antibody Ratio, DAR)、含量、效价以及其他必须的生物制品质量属性。

本文将从载药量与药物分布、游离药物、分子大小变异体和电荷变异体四个方面进行介绍,讨论各类分析技术是如何灵活配合用于表征分析ADC质量属性。
DAR及其分布
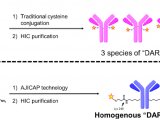
DAR(Drug-to-Antibody Ratio),即药物小分子与抗体分子的数量比例,可指示平均每个抗体上偶联上的小分子药物个数。DAR与ADC的疗效和安全性直接相关,低载药量(低DAR)会降低ADC的效力,而高载药量(高DAR)会改变ADC分子的药代动力学和毒性。常规用于定量DAR的方法有光谱(UV-Vis)、色谱(HPLC)和质谱(LCMS)等。如下图所示,已上市ADC产品在DAR分析质控上主要是光谱和色谱这两类技术。
1. 光谱方法(UV-vis)
可实现DAR监控需要有如下三个前提条件:
1)有效载荷应含有紫外可见发色团;
2)有效载荷和抗体在其紫外可见光谱中应显示出不同的吸收峰属性;
3)连接子-有效载荷的存在不影响ADC样品中抗体部分的光吸收性质。
根据抗体部分和载荷部分的不同吸光度和消光系数,依据Beer-Lambert原理计算出DAR值及ADC浓度
2. 色谱方法(HPLC)
常见的可用于DAR分析的色谱方法有疏水色谱(HIC)和反相色谱(RP)。疏水色谱利用不同载药组分的疏水性质差异进行分离,不同的固定相(苯基、丁基、醚基等)具有不同的疏水性和选择特性,采用高盐浓度流动相使蛋白结合到固定相,继而降低盐浓度进行洗脱,这种温和的结合与洗脱条件可以保持ADC药物的天然构象。HIC是可在完整分子水平上监控DAR的最佳方法,可直接定量不载药抗体(DAR0)组分,一般认为D0为非有效组分且会占据ADC结合位点影响ADC内吞。
反相色谱(RP)利用目标分子之间的极性差异进行分离,分离度较好,且方法本身质谱兼容,可直接进行不同载药形式的分子量定性。反相方法也可直观看到小分子药物在不同位点的分布情况。如下图所示,对于常规链间二硫键巯基偶联的ADC分子,由于高载药异质性,需对样品进行还原后再进行分析,目标物非完整状态,虽然可以监控药物在不同位点的分布,但无法定量完整的不载药抗体DAR0的比例。




3. 质谱方法(LC-MS)
质谱方法是另一种常用的DAR分析技术。目前使用电喷雾电离(ESI)与飞行时间(TOF)或具有更大质量范围的Orbitrap可以以足够的分辨率区分ADC的异质分子物种。例如,在还原和非还原条件下,通过完整的质量测量,可以获得ADC分子的完整质量分布。





以上三种常规分析技术拥有各自的优点和最佳应用场景,可按照ADC分子特点和所处的开发阶段,按需开发或配置相应的DAR定量方法。

游离药物
所有ADC共有的一个重要质量属性是游离(未结合)药物的数量,这会引起对毒性和潜在安全问题的关注。未偶联药物或药物相关杂质的残留量可能残留在最终产品中。未偶联药物的相关形式,如连接药物种类或其他降解产物,也可以在偶联物存储期间释放。因此,开发和应用合适的方法来检测、表征和量化游离药物是至关重要的。常规的游离药物监控方法的开发思路如下。
分子大小变异体
分子大小变异体(聚集体、片段等)是重要的质量属性,可直接影响蛋白质疗法的疗效或安全性。聚集是蛋白质最常见的物理降解途径,且ADC比抗体更容易聚集,主要是因为药物/连接子分子的存在,使连接位点的局部表面具有更多的疏水性。与抗体分析的技术一致,体积排阻色谱(SEC)、光散射(SEC-MALS)等常规技术可用于支持ADC分子聚合体的分析表征,非还原/还原毛细管电泳(non-reduced/reduced Capillary Electrophoresis)可用于支持ADC片段的分析表征。
电荷变异体
与抗体一致,ADC的电荷变异体是关键的质量属性,因为它们对稳定性和生物活性有潜在影响。在ADC中可以观察到各种形式的与电荷相关的异质性,贡献这些异质性的因素包括抗体自身展示的电荷变异性、偶联工艺过程引入的修饰、小分子药物本身的结构以及在不同偶联位点引起的电荷变化等。常规分析技术如离子交换色谱(Ion Exchange Chromatography,IEX)或者等点聚焦电泳(iCIEF)可以实现电荷变异体的监测。常规的电荷变异体表征策略也适用于ADC分子,富集单一变异体组分后,进行完整水平(Top-down)、亚基水平(Middle-down)或肽段水平(bottom-up)质谱解析。