Brooke-Spiegler 综合征 (brooke-spiegler syndrome, BSS) 是一种常染色体显性遗传的良性多发性皮肤附属器肿瘤综 合征,肿瘤主要包括真皮圆柱瘤(dermal cylindroma, DC)、毛 发上皮瘤(trichoepithelioma, TE)和 / 或汗腺螺旋腺瘤(eccrine spiradenoma, ES)。现认为有合并两种以上肿瘤发生于同一患 者或同一家系不同患者均可诊断为 BSS[1] 。笔者收治单侧多 发小汗腺螺旋腺瘤伴发圆柱瘤患者 1 例,且局部肿瘤细胞呈 毛囊分化,符合 BSS 基本特征。现结合文献复习对其临床病 理学特征、遗传学特征进行分析。
1 临床资料
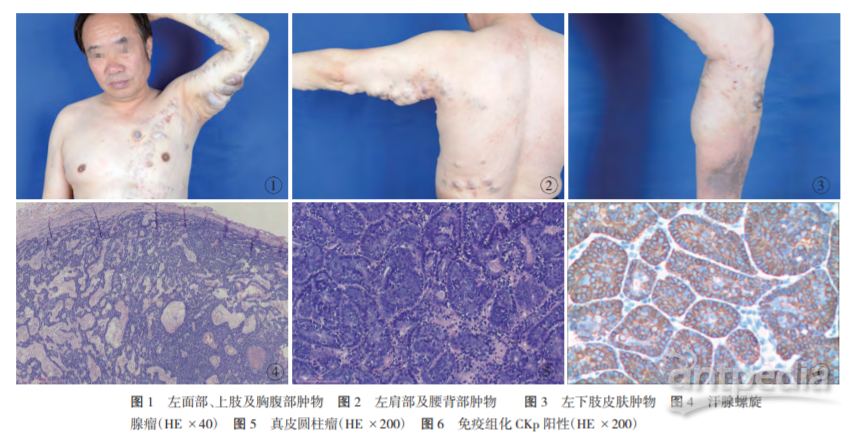
患者男性,64 岁,因“单侧多发皮肤肿物 64 年”入院,于 2019 年 10 月就诊。患者自出生时左侧面部、躯干及左侧肢体 可触及多处皮肤肿物,随年龄增长,肿物逐渐增多变韧,呈单 侧结节状条带样分布,无疼痛及瘙痒等自觉症状。父母非近 亲婚配,家族中无类似疾病。5 年前曾入院行“左胸前皮肤肿 物切除术”,术后病理示:螺旋腺瘤伴圆柱瘤,瘤实质出血坏 死,部分区域瘤细胞生长活跃;KI67(index 约 10%),P63(++), CD31(-),CD34(-),CK5/6(+)。专科检查:患者左侧的面部、上 臂及前臂屈侧、腋窝、肩部、胸腹部、腰背部、大腿后内侧、小腿 前内侧均可见泛发且大小不一的串珠样条带状分布皮肤肿物 300 余个,沿 blaschko 线(布莱施科线,简称 B 线)排列,左上 臂屈侧呈团块样丛集生长,最大者约鸡蛋大小,直径约 5 cm, 其余部位约黄豆大小,呈淡蓝色、淡紫红色椭圆形丘疹或结节 状改变,表面光滑、触之质韧有压痛(图 1~3)。超声提示:增厚 脂肪层内可见多发较低回声结节,边界清晰形态规则,内部回 声不均匀,部分结节内可见无回声区。经术前准备在全身麻醉 下切除肉眼可见的肿物,除左上臂肿物行“中厚皮片原位回植 术”外,其余部位均行美容缝合术。病理检查提示:多发小汗腺 螺旋腺瘤伴发圆柱瘤,其中以螺旋腺瘤成分为主,灶性区域瘤 组织呈毛囊分化(图 4,5)。免疫组化结果示:KI67(index 约 20%),CKp(+),CK5/6(+),Calponin(+),P63(+),CEA(灶性 +), CD3(背景淋巴细胞 +),Langerin(散在 +),见图 6。与 5 年前相 比,KI67 增殖指数增高。
2 讨论
2.1 发病特点 BSS 多发生于 14~30 岁,随年龄增长,肿瘤 数目及大小均有不同程度增加,皮损多见于头颈部。BSS 大 部分病例报道来自于欧美国家,且多见 DC 伴发家族性 TE, 国内曾报道 1 例家系病例[2] 。ES 好发于面部、躯干上部、肩部 及上肢屈侧,少见于腋窝、手部、腰背部、下腹部、下肢屈侧等 部位,男女发病率约为 1∶2[3] 。ES 通常表现为单发实性结节, 表面呈肤色、淡红色或淡蓝色改变,偶有疼痛或触痛。皮损可 呈线状、带状、痣样或沿 B 线排列[4] 。DC 好发于头皮及颈部, 常表现为隆起性头巾状多发结节,不同于涎腺、乳腺中具有 恶性性质的圆柱瘤(腺样囊性癌)[5] 。TE 好发于鼻唇沟、面颊 附近,呈对称分布的粟粒样实性结节或丘疹[6] 。以上 3 类肿瘤 均可单发或多发;多发常伴有遗传性[7] ,单发病例需与血管平 滑肌瘤、血管球瘤、神经瘤和血管脂肪瘤鉴别。本例患者术后 病理检查结果为多发 ES 伴发 DC,符合 BSS 基本特征,该患 者先天性发病,病灶主要波及身体左侧的面部、躯干及肢体, 肿物沿 B 线排列;B 线不属于皮纹线,亦不同于解剖学皮神 经分布方式,表现为半侧躯干部呈 M 形分布,上下肢沿肢体 长轴分布。
2.2 组织病理学 BSS 确诊仍以病理学检查及免疫组化染 色为金标准。包含上述两种以上肿瘤细胞。ES 低倍镜下可见 瘤体组织位于真皮和皮下组织内,呈结节状,有明显的纤维 包膜;高倍镜下可见瘤体组织由两种细胞组成,亮细胞核大、 淡染,位于瘤细胞团块中央,暗细胞核小、深染,排列在瘤细 胞索外周,其间有淋巴细胞浸润,并见导管分化。ES 免疫表 型:肿瘤细胞表达大多数类型的角蛋白、上皮膜抗原(epithelial membrane antigen,EMA)以及点状表达 S-100 蛋白,还有 P53 过表达的报道;暗细胞 CK5/6(+)、SMA(+)、P63(+)提示向肌 上皮分化;亮细胞 CK8/18(+)、CEA(+)、SYN(-)提示向腺上皮 分化;肿瘤细胞团内散在 T 淋巴细胞和朗格汉斯细胞[8] 。此 外,研究表明 ES 免疫组化的 Ki-67 增殖指数增高,则提示 有恶变可能,但本例术后病理未见恶变;DC 常位于真皮内, 瘤体由嗜酸性基底膜样物质包绕的多数形状大小不均的肿 瘤细胞团构成,细胞团组成与 ES 相同。TE 多位于真皮内,不 同程度向毛囊分化,典型病变中可见较多角质囊肿和基底样 细胞聚集而成的筛状细胞团[9] 。在 BSS 患者中,以上肿瘤可 发生于同一个体的不同部位,亦可交互发生于同一病理组 织中;本例 BSS 患者组织病理学检查可见上述两种分化方向 肿瘤,即汗腺细胞起源的 ES 和 DC,故有学者推测以上肿瘤 来源于多分化潜能缺陷的皮肤附属器干细胞。
2.3 遗传学改变 BSS 符合常染色体显性遗传特点,主要包 括 ES、DC 及 TE,这 3 种良性皮肤附属器肿瘤。国外遗传学 研究表明,这 3 种皮肤肿瘤均表现为 CYLD1 基因突变或缺 失,肿瘤多样性组合很可能是同一种皮肤肿瘤综合征的表型差异[10] 。BSS 患者的外周血中亦可检测到 CYLD1 基因突变, 家系研究进一步证实了 16q12-q13 上的圆柱瘤蛋白(CYLD) 基因在 BSS 中发生突变[11] 。目前多认为,CYLD1 基因属于抑 癌基因,包括 20 个外显子,可通过其去泛素化酶结构域使 TNF-α 信号通路中相关因子去泛素化,进而对 NF-κB、JNK、 TGF-β 等信号通路进行负向调节[12] 。截至目前,CYLD1 基因 已发现 33 种突变类型,且突变基因多位于编码序列区后部, 90%突变多见于终止密码子前出现[13] ,进而引起编码蛋白质 的功能缺陷,失去对 NF-κB 活性抑制,致使顶泌汗腺及外泌 汗腺干细胞亚群分化调控失衡,导致皮肤附属器肿瘤发生。 但 BSS 相同突变的基因型可导致不同表型,进而推测遗传因 素并非发病的独立因素,通过国内报道的首例 BSS 予以进一 步印证[2] 。本例患者为散发病例,无家族史,未行 CYLD1 基因 突变筛查。
2.4 治疗及预后 发生于 BSS 的各类肿瘤均为良性,很少 发生恶变及转移,但亦有 ES、DC、TE 向癌或肉瘤恶变的相关 报道。BSS 发病早期皮损较小,可采用放疗及 CO2 激光治疗, 但因皮损随年龄增长呈增多增大趋势,故疗效不确切且易复 发[14] ,即使外科手术亦较难彻底清除。因皮损好发于头面颈 部,且多成团块样丛集分布,严重影响患者的形体美观及生 活质量,应遵循病损切除、功能重建、美容修复的基本原则, 可行病损区切除加分区植皮或皮瓣修复,或行皮肤软组织扩 张术进行美容修复;对于病程较长者,应重点切除生长较快、 颜色改变、伴有溃疡、出血及疼痛的较大肿物。本例患者左上 臂多发性皮损符合上述特征,故予以区域皮下病损切除,并 将表面皮肤制备成中厚皮片原位回植;其他部位病灶切除后 美容缝合。
此外,对于多发性 ES 应注意询问其家族史,术后 行病理检查有助于确诊 Brooke-Spiegler 综合征,条件允许则 可行 CYLD1 基因突变筛查,国外 BSS 病例中突变率高达 70%[15] ,可为患者家系提供必要的遗传咨询及产前诊断。随着 研究进一步深入和 CYLD1 靶向药物的开发,将会为该疾病 治疗提供新思路和新方法。
参考文献略。