病例资料
病史 患者男性,68岁,因“尿检异常12年,蛋白尿增多,血清肌酐(SCr)升高1月余”,于2015-09-02入院。
2003年7月因左侧肋骨骨折查尿蛋白++++,9月至我院门诊,尿蛋白定量3.64 g/24h,尿沉渣红细胞(RBC)53万/ml(多形型),服氯沙坦钾治疗。
同年10月16日查尿蛋白定量2.19 g/24h,血清白蛋白(Alb)41.1 g/L,SCr 70.72 umoL/L,尿酸467umoL/L,双肾B超示LK/RK 109 mm/105mm,于10月22日行肾活检穿刺术,诊断IgA肾病(5/22节段硬化)。予雷公藤多苷60 mg/d、贝那普利治疗。
复查尿蛋白逐渐减少,于2004年5月停雷公藤多苷。长期规律随访,尿蛋白定量0.4~1.92 g/24h,SCr59.23-76.02umoL/L。2013年12月复查蛋白尿1.03 g/24h,再次予雷公藤多甘片60 mg/d和缬沙坦治疗。
2014年4月尿蛋白增加至4.08 g/24h,A1b38.4 g/L,将雷公藤多苷增至90 mg/d,同时患者自觉频繁水肿,于当地服用中药汤剂(具体成分不详)治疗近1年。2015年5月因水肿加重在当地住院,查尿蛋白定量6.7~9.1g/24h,Alb 18.7 g/L,SCr100.78 umol/L,多次输注白蛋白治疗。2015年6月查尿糖++。
7月3日查尿蛋白定量21.49 g/24h,RBC 21万/m1(多形型),Alb 25.6g/L,SCr 121.99umoL/L,未调整用药。8月11日门诊查尿蛋白定量16g/24h,Alb 25.5g/L,SCr 132.6 u moL/L,为进一步检查及治疗人院。患者目前精神尚可,体力、食欲、睡眠正常,体重无明显变化,大便正常,服用利尿剂情况下尿量1 000~2 000 mL/d。
既往史 1965年发现血压升高(150/90mmHg),最高达180/100 mmHg,1998年开始降压药治疗,先后更换多种降压药物,目前血压控制可;2013年发现血糖升高,诊断“2型糖尿病”,予瑞格列奈、阿卡波糖治疗,监测空腹血糖4~6 mmoL/L,餐后2h血糖8~9 mmoL/L。
家族史 父亲患“高血压”,母亲因“腮腺癌”于66岁去世,2弟1妹均患“高血压”,2女儿、1外孙及l外孙女均体健。
体格检查 体温36.6℃,血压134/78 mmHg,脉搏95次/min,心律齐,各瓣膜区未闻及病理性杂音;双肺呼吸音清,未闻及干湿哕音;腹软,无压痛、反跳痛及肌紧张,移动性浊音阳性;双下肢中度水肿。
实验室检查
血常规 Hb 121 g/L,wBC 5.1×109/L,PLT181×109/L。尿液尿常规蛋白+++,隐血+,尿糖++,pH值7。尿蛋白定量20.2l g/24h,RBC 11万/ml(多形型),尿白细胞0~1/HP;C3 32mg/L(正常值≤2.76mg/L),α2-MG 20 mg/L(正常值≤2.87 mg/L),NAG113.9 U/(g·cr)[正常值≤16.5 U/(g·cr)],RBP39.5 mg/L(正常值≤0.5 mg/L),Lyso 13.1 mg/L(正常值<1.0 mg/L),尿渗量581 mOsm/kg·H20,尿钾43.98 mmol/L,尿糖26.22 mmoL/L(尿量1 500m1)。尿单特异性游离轻链κ 227.10 mg/L,λ 157.37mg/L,κ/λ 1.44。
血生化 Alb 20.7 g/L,球蛋白13.4 g/L,尿素氮8.46 mmoL/L,SCr 119.34 umoL/L,尿酸216umoL,L,谷丙转氨酶15 U/L,谷草转氨酶22 U/L,总胆固醇6.24 mmol L,三酰甘油7.68 mmol/L,钠143.8 mmoL/L,钾3.14 mmoL/L,氯108.9 mmol/L,总二氧化碳28.0 mmoL/L,钙2.03 mmoL/L,磷1.05mmoL/L,空腹血糖4.3-4.6 mmoL/L,餐后2h血糖5.3-10.9 mmoL/L。HbAlc 5.5%。血单特异性游离轻链κ 103.33 mg/L,λ 99.2 mg/L,κ/λ 1.04。
免疫学 ANA、A-dsDNA阴性。IgG 2.36 g/L,I醇1.32 g/L,IgM 1-18 g/L,I班41.0 IU/m1,ASO<25 IU/ml,RF<20 IU/ml。补体C3 1.1 g/L,C4 0.2g/L。外周血淋巴细胞亚群CD4+743个/ul,CD8+521个/ul,CD3+ 1302个/ml,CD20+ 130个/ul。
其他血液检查 甲状腺功能:促甲状腺激素(TSH)7.0l mIU/L(0.3-4.5 mIU/L)、聊3 3.38pmoL/L(3.8~6.5 pmol/L)、T3 0.94 nmoL/L(1.23~3.07 nmoL/L)、TG 49.9(<35 ug/L),FT4、T4正常。甲状腺自身抗体均阴性。肿瘤标志物检查示糖类抗原125(CAl25)102.20Iu/ml,糖类抗原15-3(CAl5-3)38.1Iu/ml,余正常。传染病四项均阴性。抗磷脂酶A2受体抗体269.56 RU/ml。
影像学检查
双肾B超:左肾103 mm×48 mmx51 mm,右肾103 mm×50 mm×51mm,双肾皮质厚度不清,皮质回声稍增强,皮髓质界限清楚。右肾下极见一大小约5 mm×5 mm的类圆形无回声区,界清。心脏超声:主动脉瓣钙化、室间隔厚度9 mm,左心室内径46 mm,左室后壁厚度9 mm。LVEF:63%。消化系统超声:胆囊息肉,胆囊炎,脾略大。泌尿系超声:膀胱壁毛糙。
第一次肾活检病理(2003.10.22)
光镜 皮质肾组织l条。22个肾小球中5个节段硬化。肾小球系膜区轻~中度增宽,部分重度增宽,系膜基质明显增多,系膜细胞增生(图1A),毛细血管袢开放好,节段袢内皮细胞成对,数处袢与囊壁黏连,可见囊壁断裂,少数球囊外纤维化明显。
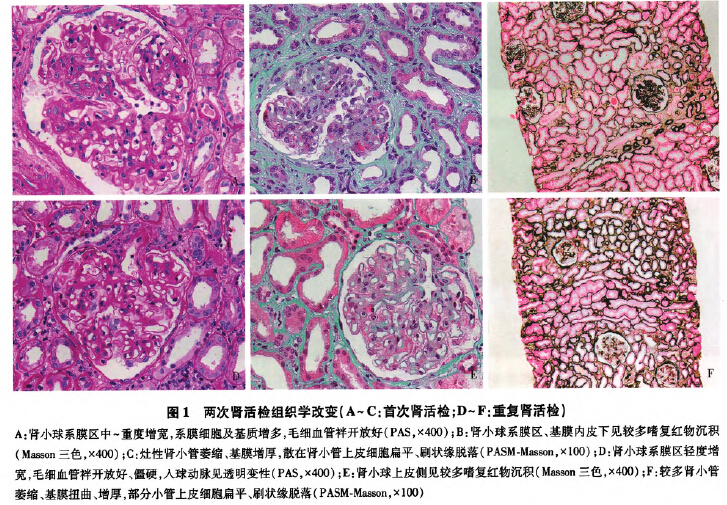
PASM-Masson:肾小球系膜区、系膜旁区较多及内皮下节段嗜复红物沉积(图1 B),少数外周袢分层。肾小管间质轻度慢性病变,灶性小管萎缩、基膜增厚(图1c),少数小管上皮细胞空泡变性,管腔内偶见蛋白管型;间质灶性增宽、纤维化+,散在单个核细胞浸润。较多小动脉透明变性。
免疫荧光 石蜡切片荧光染色IgA++、IgM+、C3+,呈颗粒状弥漫分布于系膜区及血管袢且以系膜区沉积为主(图2A)。IgG、clq阴性(图2B)。
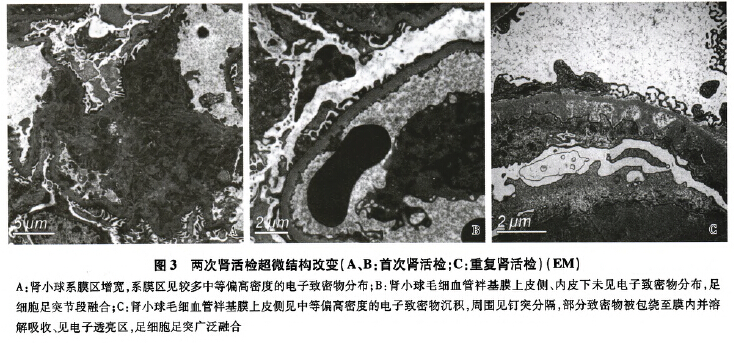
电镜 电镜下观察1个肾小球。肾小球系膜区增宽,系膜基质增多,系膜细胞增生,系膜区较多中等偏高电子密度的致密物沉积(图3A)。肾小球毛细血管袢开放好,基膜厚280~360 nm,节段基膜偏薄,约210~230 nm,基膜内皮下及上皮侧未见电子致密物沉积(图3B)。肾小球足细胞足突节段融合(约10~20%),胞质少量微绒毛化。
肾活检病理小结 IgA肾病(牛津分型M1E0SlTl)
重复肾活检病理(2015—09—08)
光镜 皮质、皮髓质、髓质肾组织各1条。28个肾小球中3个球陛废弃。余肾小球毛细血管袢开放好、僵硬(图lD),系膜区轻度增宽,系膜细胞及基质增多,节段外周袢与囊壁黏连,囊壁节段增厚、分层。
PASM.Masson:肾小球上皮侧较多嗜复红物沉积(图1E)。肾小管间质病变中度,在慢性病变基础上合并急性病变(图1F),多灶性小管萎缩、基膜增厚,多灶性小管扇平、上皮细胞刷状缘脱落,灶性小管上皮细胞细颗粒变性,管腔内见少量蛋白管型,间质灶性增宽、纤维化,单个核细胞灶性分布,少量泡沫细胞灶性分布。较多小动脉节段透明变性,累及人球动脉。
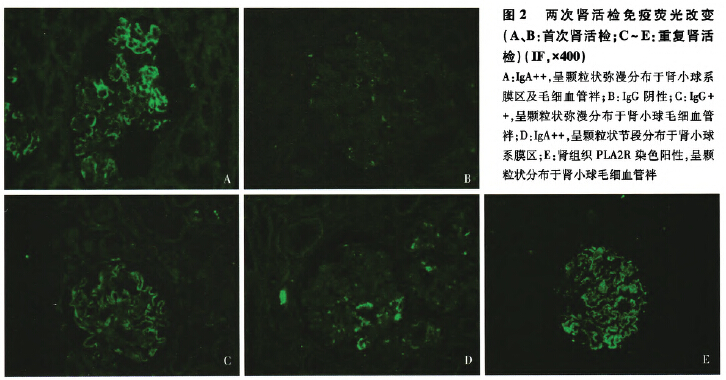
免疫荧光 石蜡切片荧光染色IgG++,呈颗粒状弥漫分布于血管袢。IgA++,节段分布,呈颗粒状沉积于系膜区(图2C-D)。IgM、C3、C1q阴性。肾组织PLA2R染色阳性(图2E)。
电镜 观察2个肾小球。肾小球基膜上皮侧见大量大小不一、高密度的电子致密物沉积,周围见钉突分隔,部分被包绕至膜内,部分致密物溶解吸收、遗留电子透亮区(图3C),个别袢上皮侧见颗粒状电子致密物分布,直径40-60 nm,偶见最大直径76nm。肾小球毛细血管袢开放好,袢腔内见单核细胞浸润,节段袢内皮细胞成对及吞饮。肾小球系膜区增宽,系膜基质增多,系膜区见少量散在电子致密物分布。肾小球基膜内皮下未见电子致密物沉积。肾小球足细胞足突广泛融合(80%-90%),胞质较多微绒毛化,胞质内见吞噬性溶酶体。
小结:肾小球膜性病变Ⅲ-Ⅳ期合并IgA肾病(牛津分型M1E0S0T2),与第一次肾活检相比,重复肾活检出现膜性病变,而IgA肾病仍存在,但此次肾小球系膜增生减轻,未见节段硬化病变,肾小管间质慢性病变加重合并急性病变,牛津分型中S1转为S0,T1转成T2。
讨论
68岁男性患者,尿检异常起病,经肾活检诊断IgA肾病,给予雷公藤多苷、贝那普利等治疗后尿蛋白减少,SCr正常稳定,10余年后病情加重,出现肾病综合征,伴少量镜下血尿及肾功能损害,重复肾活检示肾小球膜性病变伴系膜增生,免疫荧光仍见IgA系膜区沉积,新出现IgG沿毛细血管袢沉积,肾小管间质慢性化病变较前加重,同时存在急性病变。从肾脏病理来看,患者第一次肾活检光镜表现为肾小球轻一中度系膜增生伴节段硬化,系膜区、内皮下嗜复红物沉积,免疫荧光示IgA、IgM、C3沉积于肾小球系膜区及血管袢,且以系膜区沉积为主,电镜下见系膜区较多电子致密物,无上皮侧电子致密物,符合IgA肾病之诊断。
IgA肾病按病因分为原发性和继发性,常见继发病因包括过敏性紫癜、风湿性疾病(类风湿性关节炎、强直性脊柱炎、系统性红斑狼疮、干燥综合征)及肝脏疾病(病毒性肝炎、肝硬化)等。
该患者初次住院时临床无皮疹、关节痛、口干、眼干等症状,实验室检查自身抗体均阴性,补体正常,肝炎标志物检查均阴性,未查及继发因素,最终考虑原发性IgA肾病。
此后,患者经雷公藤多苷、贝那普利等治疗,病情趋于好转,尿检逐渐减轻,随访10余年SCr正常稳定。患者因尿蛋白增多、SCr升高接受重复肾活检,病理光镜表现为肾小球毛细血管袢僵硬伴轻度系膜增生、上皮侧弥漫嗜复红物沉积,免疫荧光示IgG呈颗粒状弥漫分布于肾小球毛细血管袢,IgA节段沉积于系膜区,电镜下见上皮侧电子致密物沉积伴钉突形成,系膜区亦见电子致密物,诊断考虑肾小球膜性病变。膜性肾病亦需鉴别原发或继发病因。
光镜下提示继发性膜性肾病的病变包括肾小球系膜增生及系膜区沉积物、内皮细胞增殖及内皮下沉积物,免疫荧光除IgG、C3外,同时存在IgA、IgM、C1q等阳性。
该患者虽肾小球系膜区电子致密物沉积,但免疫荧光染色C1q阴性,另外,该患者血清抗PLA2R抗体水平高,肾组织PLA2R染色阳性,均支持特发性膜性肾病可能性大,而肾小球系膜区IgA沉积则考虑是原IgA肾病的遗留。
此外,患者长期随访期间并未出现其他系统症状,复查自身抗体仍阴性、补体正常;虽甲状腺功能减低,但甲状腺相关抗体检查均阴性;肿瘤标志物检查中CAl25和CAl5-3轻度升高,但影像学并未查及肿瘤,即未发现如自身免疫性疾病(系统性红斑狼疮、干燥综合征、桥本甲状腺炎等)、感染(乙型、丙型肝炎病毒等)、药物(青霉胺、金制剂等)及肿瘤等常见的继发病因,因此该患者不考虑继发性膜性肾病。
本例患者重复肾活检膜性肾病诊断成立,同时肾小球系膜增生伴系膜区电子致密物沉积,免疫荧光除IgG外,尚见IgA阳性。Jennette等报道原发性膜性肾病约16%可出现IgA阳性,这种情况下kA与IgG沉积方式及部位一致,而该患者IgG沿毛细血管袢分布、IgA仅见于系膜区,结合继往有IgA肾病,考虑在IgA肾病基础上新出现膜性肾病。
同时首次肾活检时血清抗PLA2R抗体及肾组织PLA2R染色均阴性,本次血清抗体水平高、肾组织PLA2R染色阳性,支持患者膜性肾病为新发。
既往亦有文献报道原发性膜性肾病患者14年后出现lgA肾病,说明同一患者两种疾病可相继发生。重复肾活检虽仍见系膜增生,但增生程度减轻、系膜区沉积物亦减少,免疫荧光仅少量IgA沉积,提示I醇肾病导致的系膜增生较首次肾活检时有所好转。
膜性肾病合并IgA肾病的文献报道多为个案报道。Doi等于1983年首次报道3例患者,肾脏病理均表现肾小球膜性病变伴系膜增生,电镜下见系膜区和上皮侧电子致密物,免疫荧光及免疫电镜均证实IgG仅沉积于上皮侧、IgA则沉积于系膜区。
回顾国内外文献,膜性肾病合并IgA肾病约40余例,发病年龄在13~73岁,国外文献中男性居多,国内报道女性略多,临床表现为蛋白尿或肾病综合征,伴或不伴镜下血尿,部分患者行肾活检时已出现肾功能不全,部分长期随访病例证实两种疾病同时存在并不会加速肾功能进展。
如前所述,IgA肾病和膜性肾病均存在原发和继发,当两种病变出现于同一患者时,需明确是否继发及是否继发于共同病因,即同一病因导致患者出现两种肾脏损害类型。
Magil等报道1例乙型肝炎病毒携带合并肾脏病变的40岁男性患者,其肾脏病理兼具膜性肾病和IgA肾病的特点,免疫荧光见IgG沉积于肾小球上皮侧和IgA沉积于系膜区,电镜下见上皮侧及系膜区电子致密物,同时肾组织HBs抗原染色阳性,考虑乙型肝炎病毒可能是导致肾脏两种病理改变的病因。
Irie等报道1例44岁女性类风湿性关节炎合并肾脏损害患者,肾脏病理提示为肾小球膜性病变合并IgA肾病,其中伴节段坏死性病变的IgA肾病考虑继发于类风湿性关节炎,而膜性病变则考虑由类风湿性关节炎和治疗类风湿关节炎的非甾体类消炎药布西拉明共同导致。
Tani等报道1例银屑病伴肾脏损害患者,肾脏病理亦表现膜性肾病合并IgA肾病。大部分报道病例并未发现导致膜性肾病和IgA肾病的共同继发病因旧一引。肾移植受者中亦有类似报道。
Koselj Kajtna等报道2例肾移植术后IgA肾病复发,同时合并新生膜性肾病。目前两种疾病同时出现的具体机制尚不清楚,多认为两者分别独立发生于同一个体。
Jennette等曾报道两兄弟同时表现膜性肾病合并IgA肾病,推测某些基因可能促进两种疾病同时发生。重复肾活检另一特殊之处是肾小管问质与肾小球病变严重程度不平行,肾小球球性废弃比例10.7%,而肾小管间质病变为中度。
值得注意的是患者从2015年6月起多次复查尿糖阳性,尽管其存在糖尿病病史,但诊断糖尿病后很长时间内查尿糖均阴性,且患者血糖控制理想,因此突然出现的尿糖阳性考虑为肾性糖尿。同时实验室检查示尿钾排泄增多,血钾、尿酸水平偏低,均提示肾小管问质损伤严重。
回顾病史,患者从2013年起尿蛋白逐渐增多直至肾病综合征,门诊再次予雷公藤多苷及缬沙坦治疗,但疗效欠佳,患者未配合进一步查找原因,转而自行服中药。患者随访10余年肾功能持续正常,近期SCr却迅速升高,中药的肾毒性不能忽视。
因此肾小管间质病变考虑为长期蛋白尿和中药共同所致。这个病例亦提示临床医师,若患者在随访中病情出现明显变化,如肾炎综合征转为肾病综合征、原治疗方案无效等,需积极查找原因,必要时行重复肾活检,明确诊断,正确治疗。
小结:该老年患者确诊IgA肾病12年后出现膜性肾病,经重复肾活检证实两种常见的肾脏疾病可先后出现于同一患者,临床医师需动态观察患者病情,若临床指标变化较大,必要时需行重复肾活检评估病情,以免延误诊治。