峰形问题是反相色谱分析中最常遇到的问题之一。造成峰形问题的原因有很多,前面有文章专门讨论(HPLC峰形问题的原因分析及应对方法),也引起大家广泛的关注和讨论。本次我们重点讨论在反相色谱中由于稀释剂与初始流动相的差异造成的峰形问题,也就是常说的“溶剂效应”及其内在原因和应对方法。
1. 为什么我们需要好的色谱峰形?
色谱分析是一种非常追求准确度的分析手段,理想的峰形是高斯(Gaussian)峰形,也就是呈正态分布,左右对称。但是在实际情况下,色谱峰或多或少都会有点前延(fronting)或者拖尾(tailing),甚至完全不成单峰等,这样不仅影响分析人员看到图谱时的心情,也会降低色谱峰的灵敏度、峰面积的积分准确度以及色谱峰之间的分离度。

图1 高斯峰形示意图
2. 什么是理想的样品稀释剂?
在分析HPLC中,往往建议稀释剂为起始流动相(但在制备HPLC中,使用比流动相更弱的稀释剂更利于更大的进样体积),以避免对分离分析产生不利影响。但是在实际的工作中,样品的预处理往往使得其稀释剂和起始流动相有了很大的差异,也有一些分析方案中会建议通过蒸发除去样品预处理中的溶剂后再用起始流动相溶解样品。但是这种额外的步骤很费时间,甚至超过了HPLC分析的时间,只有在万不得已的时候才选择。也有基于其他考虑(如溶解性、样品稳定性等)而选择和流动相不一致的溶剂作为稀释剂。但是不管是何种稀释剂,只要能稳定溶解足够的样品,且对峰形等不会产生不利影响,就是理想的稀释剂。
3. 溶剂效应的原因有哪些?如何应对?
3.1 稀释剂与流动相的洗脱强度不匹配
当稀释剂的洗脱强度强于起始流动相时,也就是有机相(%B)的比例高于流动相时,我们可以估算出保留的改变(Δk):
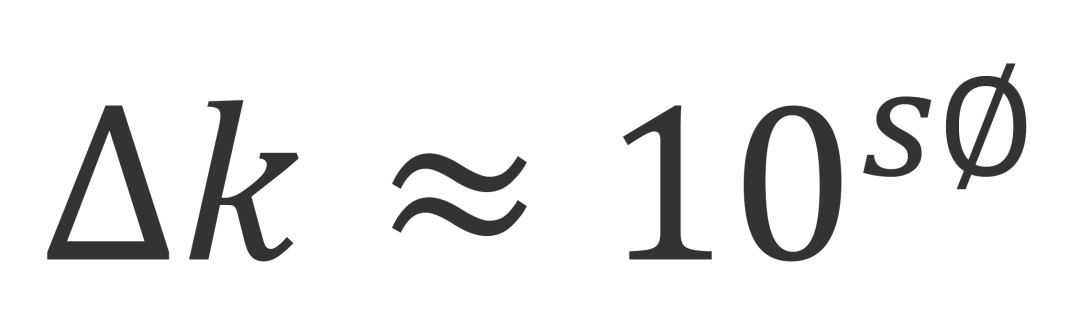
其中S和每种溶质的特性有关,S ≈ 0.25 MW0.5,MW为分子量。如果我们选择了一种典型的400 Da的小分子,当B%变化10%(即Φ=0.1)时,S ≈ 0.25×4000.5=5,Δk ≈ 105×0.1 ≈ 3.2。这意味着B相的10%的增加或者降低会导致三倍的的保留因子K的降低或者增加,也就是常说的“三倍规则”。如果一个样品的稀释剂比流动相强,进样的溶液在跑过柱子的过程中,它会和流动相以相同的流速移动,但是其中的样品分子的移动速度会比溶解在流动相时更快,进样成分会被流动相逐渐稀释直到和流动相完全一致。我们把进样的液体形象地称为“样品塞”,紧跟“样品塞”的流动相会稀释它,因此尾部的溶质分子的前进速度会慢下来,以正常的洗脱速度前进。虽然这些过程发生的速度很快,但是如果稀释剂足够强、进样体积足够大,还是会有明显的峰展宽。
Dolan作了图来更加直观地说明这种现象,在图2中每个水平放置的长条代表充满流动相(用小圆黑点表示)的色谱柱。在上面三个例子中,进到流动相的样品用棋盘格表示,随着时间的流逝从状态A逐步变到状态B和C,样品流经色谱柱,发生了稍微的峰展宽。在下面三个例子中,样品溶解在更强的溶剂中(斜线表示),A''为刚进样后的状态,“样品塞”占据的体积和A一样,因为进样量相同;在B''中,由于“样品塞”里的溶剂比流动相更强,溶解其中的样品分子会以比正常情况更快的速度通过色谱柱,与此同时尾部被流动相稀释的部分溶质分子的通过速度降低至正常速度(棋盘格部分),这样即使“样品塞”更窄(也就是进样量更少),由于前后端的稀释,样品扩散的空间也会更大;在C''中,“样品塞”基本都被稀释了,但是峰展宽一直在发生,直到所有样品都溶解在流动相中。

图2 以流动相为稀释剂(A,B,C)和以更强的溶剂为稀释剂(A'',B'',C'')时的“样品塞”在色谱柱中的运动情况示意图
在某些更极端的条件下,稀释剂的强度太大还可能导致色谱峰出现裂分甚至完全不成峰形。
当由于稀释剂由于和流动相的溶剂强度不匹配而造成峰形异常时,该如何应对?
1. 降低稀释剂的洗脱强度;
2. 降低样品的进样体积。进样体积越小,样品就越容易被流动相稀释掉。Dolan实验室尝试过在反相流动相中进样1 μL以甲苯为溶剂的样品时,可以得到满意的结果。
但是稀释剂与流动相的洗脱强度不匹配并不能解释所有情况。比如Tseing和Roger发现分析二羟基苯的异构体时,不管是将甲醇作为稀释剂,水作为流动相还是水作为稀释剂,甲醇作为流动相,最终都得到双峰,但是当稀释剂和流动相一致时,就可以得到单峰;Zapata和Garrido也发现在分析叶绿素时,当使用丙酮-水(69:31)为稀释剂,甲醇-水(95:5)为流动相时,虽然两者洗脱强度一致,但是叶素绿的峰为多峰。经过研究后发现这和稀释剂与流动相之间的黏度不匹配有关。
3.2 稀释剂与流动相的黏度不匹配
当稀释剂与流动相之间的黏度不一致时,会发生黏性指进(viscous fingering)这种流体力学不稳定现象。也就是低黏度的溶剂会如伸出手指一般向高粘度渗透,同时这种渗透是随机的,不可预测。如图3,黑色部分就是低黏度的溶剂,在更高粘度的背景溶剂中如树枝般随机“生长”。

图3 一种黏性指进的图
在色谱分析中,稀释剂与流动相的黏度不匹配对谱图的影响不仅与稀释剂与流动相黏度的不匹配程度有关,也与样品溶质及样品溶剂的迁移速度有关。当黏度差异相同时,样品的溶质与溶剂在越短的时间内洗脱,且洗脱时间越接近时,对峰形的不利影响就越明显,这种现象在体积排阻色谱(SEC)中比较常见。
正如上面提到的这种“黏性指进”是随机的,因此往往连续进样时峰形不能重现(如图4),这也是判断到底是黏性不匹配还是上面所说的洗脱强度不匹配的重要依据。
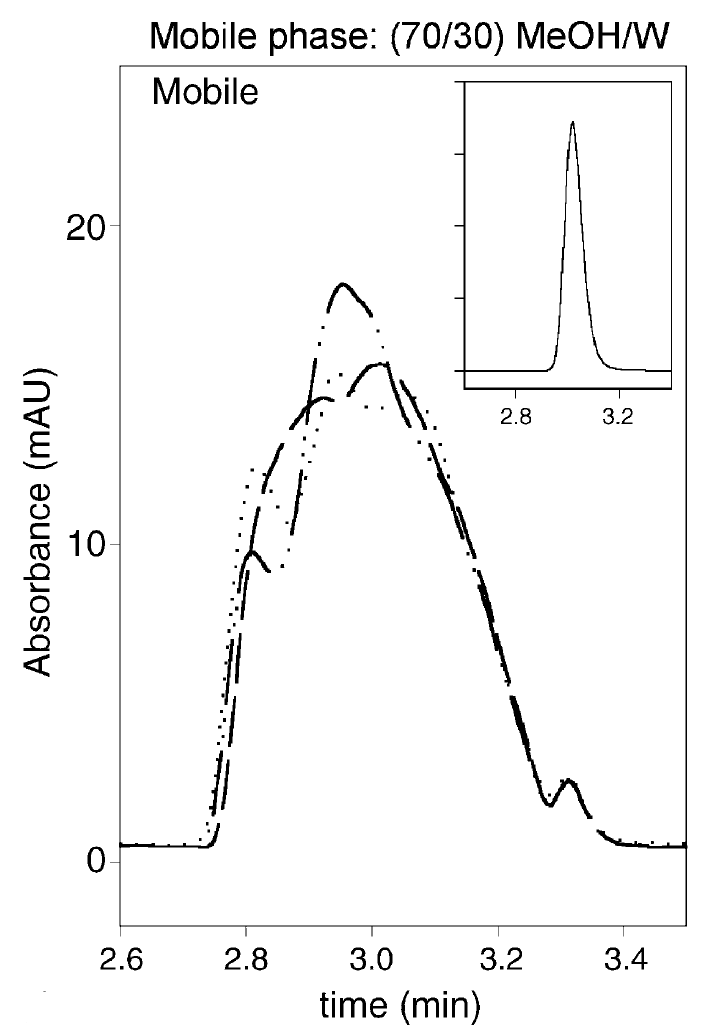
图4 三次连续进样的叠加图(稀释剂为70% MeOH,流速为0.5 mL/min),右上角的图为用流动相为稀释剂的图
当由于稀释剂由于和流动相的黏度不匹配而造成峰形异常时,该如何应对?
1. 尝试用初始流动相稀释样品,但这往往是正确的废话,因为很多情况是不能或不便用初始流动相稀释样品;
2. 降低进样量;
3. 选择更大的定量环,也就是增强在定量环中的预混,如图5。同样进样10 μL或者20 μL,当增加定量环的大小(从10 μL到20 μL或者从20 μL到50 μL)时,峰形可以明显改善。
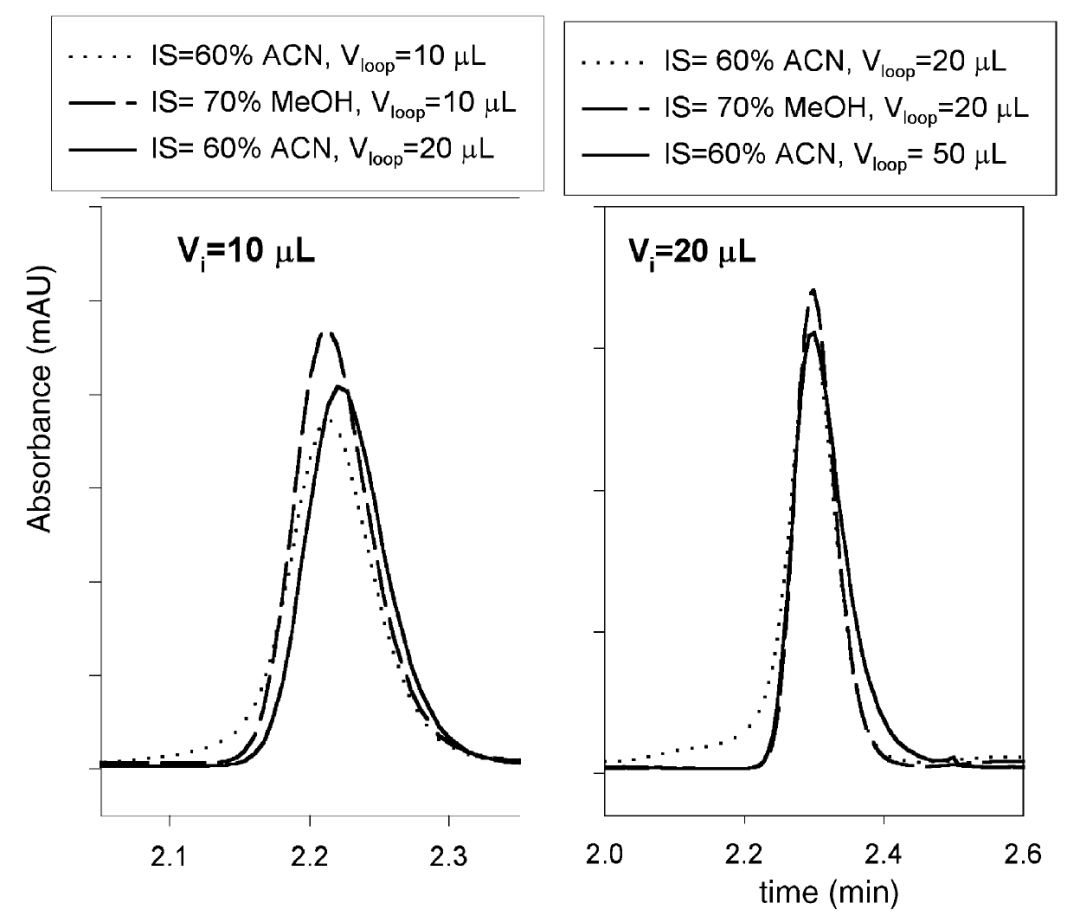
图5 不同稀释剂和定量环时的峰形叠加图(流动相为60% MeOH,流速1 mL/min)
4. 升高温度,可以在某些区间内拉平稀释剂和流动相之间的黏度差异,从而减少其不良影响,这在体积排阻色谱(SEC)中很常见;
5. 在半制备或者制备色谱中,常常增大进样量以提高效率,有时候由于溶解性问题也让使用起始流动相作为稀释剂不太现实,为了降低稀释剂和流动相由于黏度不匹配而造成分离的不良影响,强烈建议调节两者的黏度,一种可能的解决方案是在低黏度的一方中加入极少量的高黏度溶剂,比如DMSO或者环己醇。
3.3 稀释剂与流动相的pH不匹配
我们在分析可离子化的化合物时,常常会基于分析物的pKa选择不同pH的流动相,以实现最佳的分离效果。在很多情况下,样品稀释剂和流动相的pH并不一致,甚至相差好几个单位,比如样品在起始流动相条件下不稳定时,首先就应该考虑样品的稳定性。当稀释剂与流动相的pH不一致时,稀释剂在流经色谱柱时,会改变周围环境的pH,从而可能改变分析物的电离状态进而影响其保留行为。
为了更加直观地了解当样品稀释剂对流动相pH的影响,Stoll在HPLC系统中设计了一个pH的在线监测系统,可以实时测定色谱柱入口和色谱柱出口的pH值。实验中选择的苯甲酸为分析物,样品稀释剂为乙腈:1 mM或100 mM磷酸盐(pH 7)=13:87,流动相为乙腈:100 mM磷酸盐(pH 3.2)=23:77,色谱柱为50×4.6 mm的C18柱,流速为2 mL/min(其他详细色谱条件见参考文献[6])。图(a)为稀释剂中缓冲剂为1 mM pH 7的缓冲盐时,不同进样量时色谱柱入口处的pH随时间的变化图;图(b)为稀释剂中缓冲剂为100 mM pH 7的缓冲盐时,不同进样量时色谱柱入口处的pH随时间的变化图;图(c)为稀释剂中缓冲剂为1 mM pH 7的缓冲盐时,不同进样量时色谱柱出口处的pH随时间的变化图;图(d)为稀释剂中缓冲剂为100 mM pH 7的缓冲盐时,不同进样量时色谱柱入口处的pH随时间的变化图。其中蓝、紫、绿、红、粉曲线分别是进样量为1 μL、5 μL、15 μL、30 μL、100 μL的pH曲线图。

图6 进样不同浓度和体积的稀释剂时色谱柱入口和出口处的pH图
在色谱柱入口端:
从图(a)可以看出,即使稀释剂中的缓冲剂为1 mM的磷酸盐,当进样量为30或100 μL时也会在流动相中产生pH>5的区域,而当稀释剂中的缓冲剂为100 mM的磷酸盐时,见图(b),即使只进样5 μL,也会让流动相中产生pH值到6的区域。
在色谱柱出口端:
我们可以看到其最大的pH值比色谱柱入口端监测的数据要低,这应该主要和样品的稀释剂的扩散和流动相对其的中和有关。当稀释剂中的缓冲剂浓度为1 mM时,如图C,样品稀释剂在色谱柱中充分扩散和被中和,监测到色谱柱后的pH基本都低于4,除非进样量达到100 μL时,才有少量的区域pH高于4;而当样品稀释剂浓度为100 mM时,如图6D,当进样量为15 μL,30 μL和100 μL,会让色谱柱中很大的区域的pH都大于5。
而苯甲酸的pKa为4.2,当色谱柱中的pH值由流动相的3.2升高时,让苯甲酸的电离程度也提高,从而让其保留时间降低,当pH值的变化比较剧烈时(如稀释剂的磷酸盐浓度为100 mM,进样量为15 μL或30 μL),色谱峰的保留时间显著减少,同时峰的拖尾变得更加严重,而当进样量为100 μL时,色谱峰会出现严重的变形和裂分现象,如图7。

图7 进样不同的稀释剂时样品峰的叠加图
综合图6和图7可以看出,分析物的出峰行为和稀释剂对流动相pH的影响情况出现了非常强的相关性。我们可以看到当稀释剂与流动相的pH不匹配时,特别在稀释剂中缓冲液的缓冲能力比较强、进样量比较大的时,对于pKa在特定范围内的分析物的出峰行为产生不可忽视的影响。相对应的,降低稀释剂的缓冲能力、减少进样体积以及让稀释剂对流动相pH的影响范围尽量避开所关注的分析物的pKa都是有效的方向。
全文总结
在液相色谱分析中,“溶剂效应”指由于样品的溶剂(稀释剂)与初始流动相的差异而对分析物的色谱行为造成的影响,但是其具体原因却不能一概而论。本文综合了现有的一些研究,总结了三种不同原因造成的溶剂效应,包括洗脱强度不匹配、黏度不匹配和pH不匹配(当然,还有可能有其他的不匹配因素导致的溶剂效应,本文仅作抛砖引玉,如有错误或者遗漏,请在评论区指出)。当遇到具体的问题时,需要具体分析找出原因,并针对性地进行改善。
参考文献
[1] Michael W. Dong HPLC and UHPLC for Practicing Scientists, 2nd Ed. 2019, Wiley;
[2] J.W. Dolan, LC-GC North Am. 22 (2004) 26;
[3] S. Keunchkarian et al. J. Chromatogr. A 1119 (2006) 20;
[4] C.B. Castells et al. J. Chromatogr. A 805 (1998) 55;
[5] M. Czok et al. J. Chromatogr. 550 (1991) 705;
[6] D.R. Stoll et al. LCGC Europe 33 (2002) 74.