
1999年,一名患有鸟氨酸转氨甲酰酶缺乏症的患者接受一剂携带校正基因的腺病毒载体注射,产生大规模免疫反应,导致多器官衰竭和脑死亡。这是基因治疗发展历史上第一例严重不良反应事件。由于1999到2002年遭遇的这一事故和其他临床挫折,基因治疗领域的投资在随后的几年中经历了急剧而持续的下降。
但与此同时,为了确保将外源DNA更安全地引入哺乳动物细胞和生物体中,技术革新仍在继续。例如,基因递送系统的改进使得细胞因子、siRNA和其他基因替代策略的递送更安全,且在体外、体内临床前和临床应用中都体现出了有效性。
分类和基本概念
广义的基因治疗的概念即将外源性基因递送到靶细胞,以调节、改变基因组的表达。主要有三种不同的方法(图1)。基因递送载体的主要特征和组成在很大程度上取决于使用的基因治疗方法(如表一)。
基因增补:该方法通常用于面对遵循常染色体隐性遗传模式的遗传性疾病,最常用的多核苷酸为质粒 (pDNA),而由质粒介导的转染通常只能保持1~2个月;另一种常用的为单链mRNA,它的稳定时间更短,仅约1小时。
基因抑制:该方法主要用于沉默突变基因的表达。这这种情况常见于常染色体显性遗传之后的遗传性疾病模式。抑制序列可以是基于单链RNA的结构,如microRNA (miRNA),或双链RNA结构,如小干扰RNA (siRNA)。
基因编辑:用特定的基因编辑工具以永久性纠正突变基因,如CRISPR/Cas9。如CRISPR/Cas9的基因编辑工具可以用不同的载体进行递送,如pDNA、mRNA或核糖核蛋白 (RNP)复合物,以作用于不同的细胞区域。

图1 三种不同类型基因治疗(广义)示意图。a) 基因增补疗法;b) 基因抑制疗法;c) 基因编辑

表1 寡核苷酸基因治疗中使用的主要多核苷酸的基本特征和性质示意图
病毒载体和非病毒载体
载体是目的基因到达其目标目的地的载体,它在产品的安全性和有效性上起到了至关重要的作用。常见的递送载体可分为病毒载体和非病毒载体。当前一部分的临床研究已经应用了非病毒载体,但更多的还是保持了传统的病毒载体系统。
目前市场上有超过20种基因治疗产品,其中3种为非病毒产品(如表2),其余均采用病毒载体递送系统。Neovasculogen是第一个非病毒基因治疗产品,由人类干细胞研究所(俄罗斯)开发。它由编码血管内皮生长因子(VEGF-165)的质粒作为载体。第二个产品是Collategene,一种编码AnGes(日本)开发的人肝细胞生长因子(HGF)基因的质粒DNA。还有一个产品是Spinraza(nusinersen),一种反义寡核苷酸,用于治疗儿童和成人的脊髓性肌萎缩症。
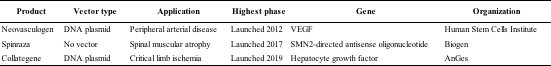
表2 使用非病毒载体递送的基因治疗产品
病毒载体可以高效递送基因,有效生成持续修饰的哺乳动物基因组。但同时,它们也存在一些限制和缺点。
使用逆转录病毒(包括慢病毒)载体存在插入诱变的风险;
使用病毒载体,免疫原性反应和炎症增强的风险增加;
当病毒DNA作为外来DNA引入哺乳动物细胞时,它容易出现表观遗传沉默;
病毒生产所需的成本高,对于大规模商业化生产控制成本并不友好。
非病毒载体可以一定程度上避免病毒载体的限制,它具有以下优势:
使用非病毒载体更容易实现大规模生产和化学表征,能够大规模提高生产的可重复性;
非病毒载体具有更高的载量,更大的转基因能力;
使用非病毒载体毒性低,免疫原性反应小,安全性更高。
然而依然有一定的壁垒存在。与病毒载体系统相比,非病毒系统的效率仍然相对较低,因为编码转基因的表达仍然是短暂的。为了克服非病毒载体固有的挑战,仍然需要进行技术的优化和革新以确保非病毒系统的稳定性和有效性。
非病毒载体在体外细胞治疗领域的应用
在体外细胞治疗领域,除了常见的用逆转录病毒或慢病毒载体引入CAR基因的方式,还有转座子、mRNA、CRISPR/Cas9的方式。
转座子:转座子由一个携带CAR的质粒和一个携带转座子酶的质粒组成。它具有装载量大、安全性高等优势。这类新系统已证明能够实现较为安全的基因整合,同时保持高效的递送效率,有限的脱靶效应,并可以生成基因表达稳定可靠的转基因细胞。常见的转座子系统有睡美人转座子(Sleeping Beauty,SB),PiggyBac等。
mRNA: mRNA电穿孔是将CAR基因导入T细胞最简单的方法,但是可以转染的基因容量更小,转染效率相对于病毒载体以及转座子而言都要更低。不过这种方法相对而言成本更低,耗时更短,安全性相对较好,没有插入诱变,并且免疫原性可以忽略不计。
CRISPR/Cas9:CRISPR/Cas9基因编辑技术是当前使用最为广泛的基因编辑技术,它可以通过敲除TRAC等分子,避免GVHD和免疫排斥使CAR-T变成通用型;还可以敲除免疫检查点或抑制性分子来提高T细胞或者其它免疫细胞的功能。
无论哪种非病毒技术,都需要将外源基因通过一种高效的方法导入到大量的细胞中。电穿孔已被证明是非病毒转染中极具前景、且已经是应用最为广泛的技术之一。
电穿孔技术的应用
目前已上市的电穿孔平台,存在以下缺点:
平台不开放,参数调整优化难
体系放大一致性欠佳,工艺开发生产转化难
亦或是商业模式不大友好,使用成本高昂
寻找降本增效的电转方案是行业一致的诉求。
在电转技术方面,赛默飞早有储备。10多年前赛默飞已推出了Neon电转系统,N在高校和科研院所广泛应用,在免疫细胞中基因编辑领域积累丰富经验。基于与细胞治疗领域专业客户的多年深度合作,赛默飞于2022年推出Gibco™ CTS™ Xenon™大规模电转染系统,保持了与Neon一致的脉冲配置和开放的操作平台,通过简单的优化,即可实现研发到生产的体系放大。此外,满足大体积、符合GMP生产需求的Xenon也不会收取任何license fee或milestone费用,真正做到降本增效。

图2 Gibco™ CTS™ Xenon™大规模细胞电转染系统
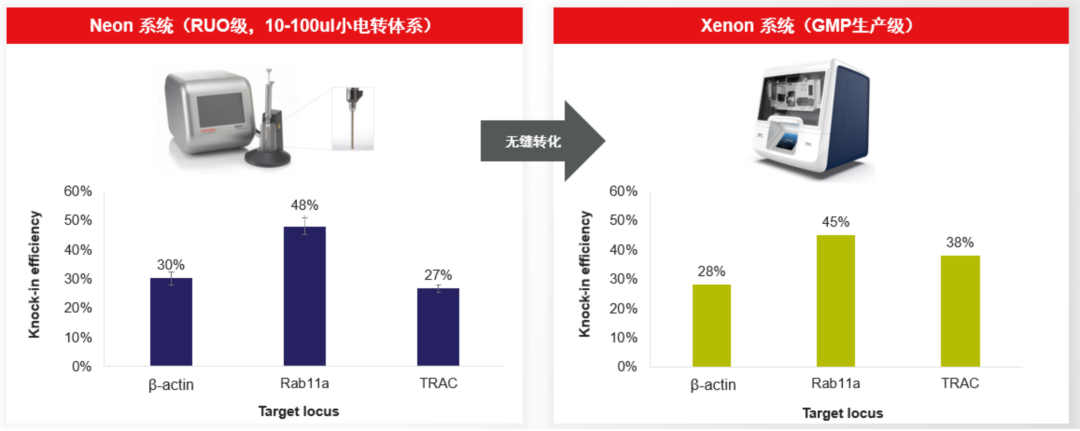
图3 使用Neon和Xenon,对细胞进行Cas9 RNP和dsDNA的电转,两系统在不同的位点对应的KI效率相当。
Gibco CTS Xenon 电转染系统特点
处理量大且快速:处理量为1–25mL,25分钟内能够转染多达2.5x10⁹个T细胞;
性能可靠,可保持高细胞活力:高达90%的基因敲除效率和80%的细胞活力;
工艺灵活性高:仪器配备了用户可编程系统,允许用户在细胞治疗的工艺开发到商业化生产的所有阶段,根据各种细胞类型和目标递送物创建并优化电转染方案;
非病毒性物理转染:可用于递送DNA、RNA和蛋白质;
封闭式系统处理工艺:MultiShot(MS)耗材可以无菌焊接至PVC管或C-Flex管。
Gibco CTS Xenon 电转染系统特应用案例
Gibco™ CTS™ Xenon™大规模细胞电转染系统,助力行业客户突破细胞治疗大规模电转染的难题,为通用CAR-T、CAR-NK、TIL、TCR-T等创新疗法提供了非病毒生产的新选择。
1
Gibco™ CTS™ Xenon™实现高效T细胞基因编辑
使用Cas9/gRNA敲除内源性T细胞受体(TCR)并敲入表达第二代CAR构建体的双链线性DNA。使用Invitrogen™ Neon™电转染系统(100 μL),或在CTS Xenon大规模电转染仪器上使用Xenon SingleShot电转染腔室(1 mL)或Xenon MultiShot电转染套件(18 mL)转染5×10⁷个细胞/mL,并设置未转染组。转染3天后,通过流式细胞术分析评估CAR T细胞上的CD19基因表达。使用细胞计数仪和Gibco台盼蓝染色评估细胞活性。

图4 对三个来源于白细胞单采术的T细胞供体进行CAR T细胞电转染分析
2
Gibco™ CTS™ Xenon™可实现高效NK细胞基因编辑
使用Cas9/gRNA敲除内源性B2M基因。使用Invitrogen™ Neon™电转染系统(100 μL),或在CTS Xenon大规模电转染仪器上使用Xenon SingleShot电转染腔室(1 mL)5×10⁶个细胞/mL。转染3天后,通过流式细胞术分析评估NK细胞阳性率(中间列)及B2M基因敲除效率(左边2列)。使用细胞计数仪和Gibco台盼蓝染色评估细胞活性(右列)。

图5 三个来源于白细胞单采术的NK细胞使用CTS NK-Xpander培养基培养6天后,计数并进行NK细胞电转染分析。
3
Gibco™ CTS™ Xenon™可助力
大规模HSC (CD34+ T)细胞的基因改造
在电穿孔后的细胞培养过程中,不同系统间细胞活力相当 (A), 基因编辑效率也都维持比较高的水平,CTS Xenon 1ml SS平均编辑效率为82%±9,Multi-shot平均为75%±8 / 5ml,Neon 100 μL平均基因编辑效率为81%±7(B)。

图6 分别使用Neon 100 μL系统和Xenon 1ml SS及5-25ml MS系统电转HSCs细胞,评价Neon到Xenon的可扩展性。
Gibco CTS Rotea逆流离心系统
为了满足细胞治疗生产工艺往自动化封闭式的生产需求,我们开发出成熟工艺,利用CTS Rotea逆流离心系统灵活、温和、输出体积可低至5ml的特点,实现电转前细胞电转液的小体积、高密度、封闭式置换,输出密度可高达5E8细胞/ml,回收率>80%,活率> 90%。

图7 Rotea与Xenon物理连接:利用Rotea将待电转细胞进行洗涤并置换成电转液,然后通过管路无菌热接接至Xenon multishot管路中,将需电转的细胞以及payload泵至Xenon电转仪,实现全封闭的电转流程。
Rotea可做到高精准度、低体积输出并维持高细胞活率和高回收率的仪器,我们也经过内部和客户多方测试,发现经CTS Rotea逆流离心系统洗涤浓缩置换电转液的样品,后续基因编辑效率与细胞活率都与手工离心置换电转液组相当。

图8 单采血分离PBMC后,使用dynabeads 一步法分离与激活T细胞。2天后,分别用Rotea和手工离心对激活的T细胞进行洗涤和电转液置换,随即进行电转,电转分别采用Neon小电转和CTS Xenon大规模电转进行测试。图中上部分为基因编辑效率,在电转3天后,3个不同的donor中,Rotea组和手工离心组的基因编辑效率都是相当的,Xenon在21%-36%,Neon为10%-15%。图下半部分展示了对应各组细胞活率,均维持在90%左右。
总结
基于在非病毒细胞改造技术方面的多年经验积累,在结合如CTS Dynabeads、OpTmizer™ Pro,NK-Xpander培养基等高品质的原材料和Attune流式在线分析和qPCR等质控分析方案基础上,赛默飞全新推出如CTS Xenon大规模电转仪、CTS Rotea逆流离心细胞处理系统以及DynaCellect新一代自动化磁珠分选平台,通过各仪器的物理连接及Cellmation数字化整合软件,赛默飞打造了一流的封闭式、模块化和自动化非病毒细胞治疗生产解决方案。这一套可扩展性生产解决方案,可帮助大家实现不同类型细胞疗法的降本增效及国际化工艺生产的需求。

图9 赛默飞非病毒细胞治疗生产解决方案概览

