2017 年 12 月 22 日,冬至。那天刷爆朋友圈的除了饺子还有国家食品药品监督管理总局药品审评中心( CDE )发布的“关于公开征求《已上市化学仿制药(注射剂)一致性评价技术要求》意见的通知”。继口服固体制剂一致性评价之后,品种更多、药物占比更高的注射剂的一致性评价也被提上了日程。
在《已上市化学仿制药(注射剂)一致性评价技术要求》(征求意见稿)(以下简称“意见稿”)中,明确规定了原料药的元素杂质、包材相容性和质量工艺中元素杂质的检测等内容。意见稿中还要求“根据 ICH Q3D 的规定,通过科学和基于风险的评估来确定制剂中元素杂质的控制策略,包括原辅包、生产设备等可能引入的元素杂质”。而对于包材的相容性研究,则“按照《化学药品注射剂与塑料包装材料相容性研究技术指导原则》、《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》等相关技术指导原则”,对迁移入注射剂药液的常见元素包括 Na、Pb、As等开展相关工作。

工欲善其事,必先利其器。元素杂质检测作为注射剂一致性评价这场战役的一个重要战略要地,它的完美攻克还需强大、全面、性价比高的分析仪器协助。
对于要开展元素分析的实验室,选择什么仪器,性价比最高呢?
现行的《中国药典》二部中推荐使用分光光度计进行重金属检测的比色法分析,但此方法只能通过颜色来判断几种重金属的总量,无法判断单个元素的含量。
对于包材相容性研究,相关指导原则推荐使用原子吸收光谱仪( AAS )、电感耦合等离子体发射光谱仪( ICP-OES )和电感耦合等离子质谱仪( ICP-MS )。ICH Q3D 推荐使用 ICP-OES 和 ICP-MS 。但在分析 Cd、Pb、As、Hg 等必检元素时,由于PDE限量较低(对于注射剂,分别为 2、5、15、3 µg/day ),按照 100 g 的日摄入量和 100 倍的前处理稀释倍数,J 值分别为 0.0002、0.0005、0.0015 和 0.0003 µg/g,因此检出限较高的 ICP-OES 就难以胜任这些元素的检测任务。
如此综合评估下来,ICP-MS 就成为了最佳选择。
在进行注射剂一致性评价中元素杂质的检测时,会面临哪些难题呢?
某些注射剂品种从未进行过元素杂质检测,操作者无从下手;
多种注射剂中含有大量 Cl (如盐酸氨溴索液和盐酸替罗非班注射液等)或溶于氯化钠/葡萄糖氯化钠注射液中,因此 40Ar35Cl、35Cl16O 会对 75As、51V 的测定造成质谱干扰;
有些品种的注射剂需要使用 100% 的有机溶液(如 IPA、DMSO 等)溶解,而传统的 ICP-MS 仅能耐受低比例的有机试剂;
刚接触元素分析的操作者,面对注射剂中每个元素杂质 J 值的计算,一筹莫展;
方法开发和验证时都涉及到专属性讨论,但法规中仅有寥寥数语,表述不明确,让操作者头疼不已。

安捷伦作为制药行业分析仪器的主要供应商,积极应对注射剂一致性评价中元素杂质检测的众多难点,并成功开发了一系列解决方案供广大行业专家参考。
针对从未进行过元素杂质检测的注射剂品种,安捷伦 ICP-MS 具备同时进行筛查和定量的性能,为您提供准确定量的同时可筛查出所有潜在的元素杂质。
安捷伦 ICP-MS 还具有优异的灵敏度和基体耐受能力,使用单一He作为碰撞气,可轻松解决Cl离子带来的质谱干扰和基质的高盐问题,100% 有机试剂(如乙腈、IPA 等)直接进样也不会对分析结果造成影响。
安捷伦 ICP-MS 的控制软件 Masshunter 具有专门针对 ICH Q3D 而设计的功能,涵盖了 PDE、日剂量、J 值计算等内容,一个软件即可轻松完成法规的适配和所有数据的计算。
安捷伦还开设了专为“注射剂一致性评价”元素杂质分析 ICH Q3D 定制的应用支持服务(货号:R4481A,2018 年 4 月 1 日起可订购),内容涵盖了方案解读、前处理开发、完整工作流程建立、数据完整性讨论等,为注射剂一致性评价中元素杂质的测定提供全方位的技术支持。

安捷伦注射剂中元素杂质分析解决方案的实际应用效果又如何呢?
拿常见的脂肪乳类注射剂为例。常规检测方案是进行消解等前处理后才能上机测定。为了能够最大化的减少前处理步骤、提高分析效率,安捷伦测试了多种溶剂及其组合试剂,最终发现某有机试剂能够完全溶解脂肪乳,无需其它前处理就可以直接采用 ICP-MS 进行元素杂质含量的测定。这样,原来需要一天才能完成的检测任务,现在一个小时就能完成,分析结果(见下表)也相当令人满意。
某脂肪乳注射剂元素杂质检测及加标结果
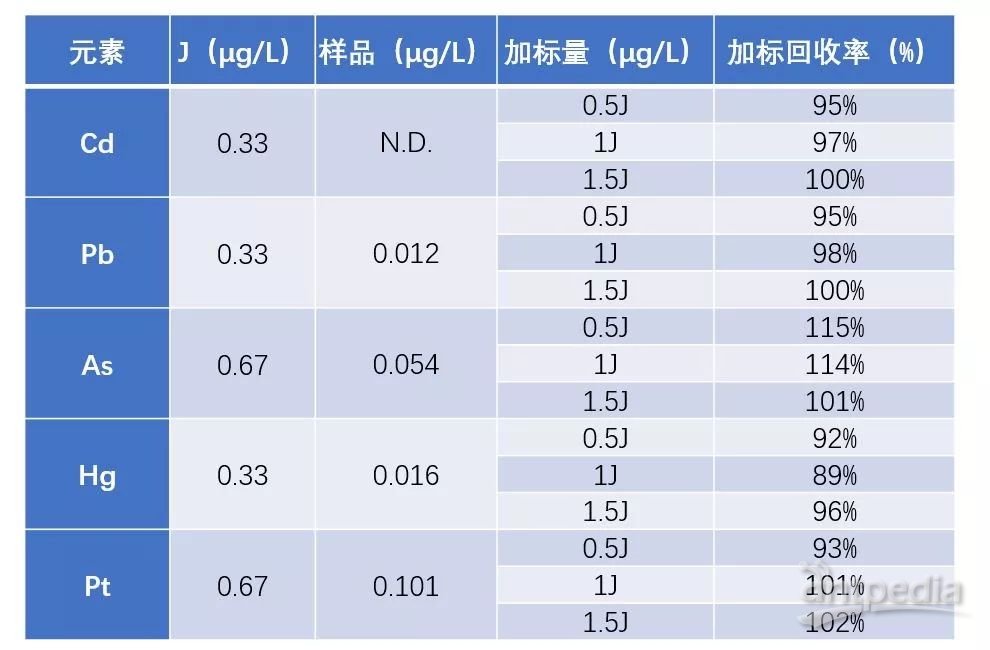 注:脂肪乳样品用有机试剂稀释 15 倍后直接上 ICP-MS 进行测定,无需其它前处理;N.D. 代表未检出。
注:脂肪乳样品用有机试剂稀释 15 倍后直接上 ICP-MS 进行测定,无需其它前处理;N.D. 代表未检出。
对于注射剂与包装容器相容性的研究,安捷伦也早已开展过相关的工作。以某玻璃包装容器的元素向注射剂中迁移情况的研究为例,结果表明迁移元素的含量差异较大, Na、Al、K、Fe 等元素含量超过 1000 ppb、最高约 50000 ppb,含量较低的 Cd 小于 0.01 个 ppb,范围跨度大。

看到这里,了解了安捷伦 ICP-MS 强大的硬件和灵活的软件,再加上贴心的本土定制化解决方案产品的助攻下,您是否对安捷伦公司提供的注射剂中元素杂质分析解决方案信心爆棚?
心动不如行动,马上联系安捷伦,了解更加详细内容。相信在安捷伦的助力下,您的注射剂样品将早日通过一致性评价审核!
安捷伦还将在不久后就此方案的细节举办网络研讨会,敬请期待。
本文使用权归安捷伦科技(中国)有限公司所有,未经授权请勿转载至其他公众号,如需转载,请与工作人员联系,并注明出处。
