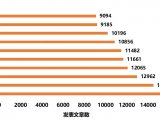
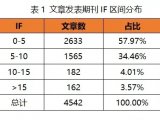
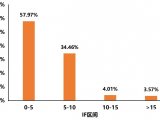
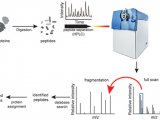
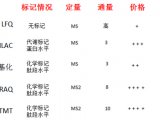
1 蛋白质组学概述
“蛋白质组”一词的英文是Proteome,它是proteins 和genome 两个词的组合,意思是proteins expressed by a genome,即为基因组表达的蛋白质[1]。蛋白质组的概念是1994 年由Wilkins首先提出,并首次在1995 年7月的“Electrophoresis”上发表,指“一个细胞或一种组织基因组所表达的全部蛋白质”[2], 蛋白质组学(proteomics) 是从整体水平上研究细胞内蛋白质的组成及其活动规律。与基因固定不变的基因组不同,蛋白质组作为相应基因组所表达的产物随时间、地点、环境等条件变化。在同一机体不同的组织和不同细胞中、蛋白质的种类、数量不同; 即使同一组织或细胞在不同的发育阶段、生理状态、甚至不同的外界环境下,其蛋白质组也是在不断的变化之中; 在病理或治疗过程中, 与正常生理过程也不同。因此, 蛋白质组是一个动态的概念。其目的是从整体的角度分析机体内动态变化的蛋白质组成成分、表达水平、修饰状态,了解蛋白质之间的相互作用和联系, 揭示蛋白质功能与生命活动的规律。蛋白质组学的研究分为3 方面: (1) 蛋白质大规模鉴定和转录后修饰的微特征研究。(2) 差异显示蛋白质组学,即蛋白质表达水平的研究, 对肿瘤等疾病的应用有着广阔的前景。(3) 蛋白质间相互作用和翻译后修饰的研究[3]。分析不同蛋白质的表达可用来比较正常组织和肿瘤组织之间的差别,蛋白组学将成为鉴别疾病的标记物,可以阐述某种机制,这种机制在越来越多的分析中被应用。人类的基因组比预期要小的多,并且基因组计划中的肿瘤相关基因现在才被知道,然而较小的基因不能反映单一的蛋白质组。通常,广泛的翻译后修饰例如磷酸化、糖基化,蛋白水解处理作用都是很常见的方式。蛋白质翻译后修饰能够显著地改变蛋白质的功能,因此可以表达出细胞和组织特征。因此,在基因组中,蛋白组学的挑战之一就是通过蛋白效应器的知识理解组织特征,并且把它应用到临床中。
2蛋白质组学分析方法
蛋白质组学可以利用蛋白微数列、电泳和质谱分析法检测、识别和特征标记的蛋白进行分析。这些方法有其独特的优点和局限性,根据各自能力评估蛋白质组谱。
2.1蛋白微数列技术
蛋白微数列是将大量抗体或者大量组织蛋白质样品一次标记在载玻片上进行检测分析。这种方法能够检测大量蛋白质的存在或者大量组织样本表达的水平,但是这种技术在特异性和敏感性抗体的可用性方面是有限的。此外抗体的特异性必须通过免疫印迹证实,并且需要内部的对照,尤其是抗体的微数列没有预测的亲和力和特异性。尽管如此,大量商品化抗体的应用使得应用蛋白微数列成为可能。
2.2 双向凝胶电泳
双向电泳在1975年由O’Farrell发明,其原理是:第一向基于蛋白质的等电点不同,用等电聚焦分离.第二向则按分子质量的不同用十二烷基硫酸钠-聚丙烯酰胺凝胶把复杂蛋白混合物中的蛋白质在二维平面上分离,这种方法尤其适用于分子量相似的蛋白质。采用蛋白质组重叠群 , 即利用多个不同pH梯度和分子量上相互重叠的2-DE 图谱, 拼接成一张完整2-DE 图谱, 大大提高了分辨率和进样量, 这对于低丰度蛋白的检出十分有利。个别蛋白质可以被染色水解为肽,这些可以通过质谱分析法进行分析。肽的酶解图谱可以根据蛋白质的数据库进行分析。
2.3 质谱分析法
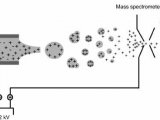
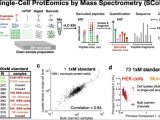
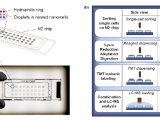
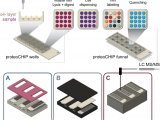
蛋白组学主要的工具之一就是质谱分析法。这种方法是将基因转变成气体离子后,根据投料比例分析蛋白质。吸解作用和离子化技术例如基质辅助的激光解吸离子化技术,为检测和分辨蛋白质提供了高水平的敏感度和精确度,这种技术的高敏感度和样品的简化使得这项技术便利化,但是它也存在局限性。分析复杂的样品例如血清相比检测蛋白困难大的多。
3 蛋白组学的分析仪器比较
方法 | 原理 | 优点 | 缺点 |
电泳 |
水溶性的蛋白根据电场的原理从负极向正级移动,移动的速率取决与其电荷、大小和形状。 | 蛋白被识别之前凝胶剂肯定被染色,凝胶剂染色本身没有用处,如果没有另一种检测技术的使用,诸如免疫印迹或者质谱分析技术,蛋白不能被精确地鉴别。 | |
SDS-PAGE聚丙烯酰胺凝胶电泳
| 蛋白质移行通过惰性聚丙烯酰胺凝胶,孔径大小的可调节性可阻止蛋白,SDS是负电荷的洗涤剂,它可以展开蛋白质的分子链,成为游离的分子,蛋白质以不同的速率向正极移行。 |
分离所有类型的蛋白质,甚至那些非水溶性的蛋白质。 |
一维分离方法分离是有限的。接近倾向重叠,仅能解决小分子量的蛋白质。 |
二维凝胶电泳
| 第 1 相电泳是根据蛋白质的等电点不同在p H 梯度胶中进行等电聚焦电泳。第 2 相电泳根据蛋白质等电聚焦的原理,根据蛋白质分子量的大小在凝 胶 电 泳 ( SDS-PAGE)进行蛋白质分离 。 |
同多种蛋白凝胶电泳相比,这种方法分离混合物分辨率高,根据图像分析比较便利,蛋白质分解的大约每毫升1ng。 | 高丰度蛋白存在可能是模糊的(例如白蛋白、免疫球蛋白)低丰度蛋白的分离蛋白质需要从凝胶中移除斑点,消化,利用质谱分析法分析肽,它不能分辨小分子重的蛋白质(<10,000 Da)。不能顺从多变的分析。 |
二维荧光差异凝胶电泳
| 二维电泳使用不同的青蓝燃料从不同的样品中标记蛋白,在不同的光的波长发生酶倍增免疫测定技术,混合样品中达到三种的样品能够被标记(测试、对照、参考) | 从混合物中分析不同的蛋白质这种方法很简单,在单一的凝胶中可以得到蛋白质表达的速率,在每一个凝胶或者是不同凝胶之间变化的复位由一个内部的标准,非常敏感。 | 高丰度蛋白存在可能是模糊的(例如白蛋白、免疫球蛋白)低丰度蛋白分离蛋白质最终需要从凝胶中移除斑点,消化,利用质谱分析法分析肽,许多斑点不能辨别,因为材料的缺乏,它不能分辨小分子重的蛋白质(<10,000 Da)。 |
蛋白质芯片多种蛋白质的芯片、细胞因子芯片、组织微数列 | 已知的蛋白质局限到一个表面(念珠、硝酸纤维素),利用免疫测定的原理检测。 | 高敏感率和处理量,多种分析物可以同时测定。 | 有限抗体的有效性和特异性需要一些先前蛋白质表达的知识。可能不能检测分析亚型。 |
基质辅助的激光解吸离子化-飞行时间-质谱技术
| 决定蛋白质或者肽片段的精确积聚。蛋白质或肽片段是由有机酸间质混合而成的,在金属载玻片上干燥,激光离子化破坏肽类片段, 这可以使得在电场中向检测器方向移动。到达检测器的时间取决于电荷和形状。通过质谱分析技术可以获得肽类的遗传信息。 | 最大的测定分子量<3000Da | |
蛋白质芯片表面增强激光解析电离-飞行时间-质谱技术
| 与基质辅助的激光解吸离子化-飞行时间-质谱技术比较,不同点在于它使用了色谱技术,从复杂试样中,有选择的结合蛋白质亚型。 冲洗移去表面非特异性凝结蛋白质和其他物质,这些物质可以干扰离子化的进程。(盐,去污剂等) |
高流通量病毒免疫测定自动化;样本量最小;初步分离原材料可以增强低丰度蛋白的检出率。
| 不能直接辨别蛋白质。对高分子量蛋白质(分子量>20 kDa)不敏感。 |
稳定同位素标记
| 生物样本使用不同的稳定同位素,这些同位素使用变调剂靶向于一种特异性的氨基酸。介于分离和质谱分析法之后,两个不同样本的肽在不同质量单位的特异同位素中使用,能获得相对量化。 |
蛋白组学比其他方法普及。在大量的蛋白质中能获得度量信息。通常能获得相关蛋白的识别数据信号。 | 高技术要求,低处理能力。样本在检验前需经过胰蛋白酶处理。这种可靠的方法适合于检测大量蛋白质。 |