中国科学院深圳先进技术研究院合成生物学研究所、深圳合成生物学创新研究院甘海云课题组在PNAS上,发表了题为《复制胁迫状态下芽殖酵母中Rad53耦联先导链和后随链DNA合成的机制》(A mechanism for Rad53 to couple leading -and lagging-strand DNA synthesis under replication stress in budding yeast)的论文,揭示了DNA复制检验点通路成员协同响应DNA复制胁迫的分子机制。
细胞分裂前的物质准备过程中,需要完成对遗传物质的复制。以有丝分裂为例,遗传物质DNA的复制主要发生在分裂前的S期。DNA能否及时准确的复制,既关系到细胞能否完成分裂,又关系到遗传信息能否被准确地传递给子代细胞。然而,DNA复制过程中会遇到影响复制的因素,如DNA损伤、双脱氧核糖核苷酸(dNTP)水平降低、转录与复制机器遭遇等。此类现象称DNA复制胁迫(replication stress)。
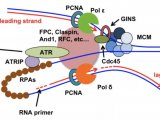
为了应对复制胁迫,生物体进化出检验点(checkpoint)机制(图1):DNA复制胁迫发生时会产生单链DNA,感应器蛋白感受到单链DNA的存在后,会激活激酶Mec1(哺乳动物中的同源蛋白为ATR),Mec1被激活后通过磷酸化下游蛋白的形式将信号逐级转导至效应激酶Rad53(哺乳动物中的同源蛋白为Chk1),激活后的Rad53会对DNA复制过程进行多重调控以应对复制胁迫。尽管Rad53作为响应DNA复制胁迫的检验点早已明确,但这一过程中Rad53如何协调复制机器中较多蛋白的具体分子机制尚不清楚。
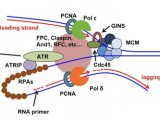
2014年以来,甘海云致力于DNA复制机器响应DNA复制胁迫的机制研究,与合作者开发了eSPAN技术(Molecular Cell,2014),该技术使特异检测DNA复制过程中前导链和后随链结合蛋白成为可能。eSPAN(enrichment and sequencing of protein-associated nascent DNA)技术巧妙地将BrdU(脱氧核糖核苷类似物,溴脱氧核苷尿嘧啶)标记的新生DNA链富集技术与染色质免疫共沉淀(ChIP)技术结合,并利用新生前导链与新生后随链方向不同的特征来探究蛋白在前导链和后随链上的结合情况(图2)。
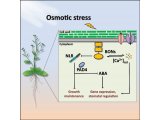
科研人员利用该技术对比分析了DNA正常复制与DNA复制胁迫状态下前导链与后随链结合蛋白的异同。结合对比分析结果和相关遗传学研究结果发现,当降低胞内dNTP水平使DNA复制处于胁迫状态时,位于滞后链的上的PCNA会在检验点激酶Mec1和Rad53的调控下,从滞后链上脱离以维持复制胁迫状态下的基因组稳定。研究进一步运用该技术对比分析了检验点激酶Rad53缺失与否状态下的复制叉及其结合蛋白的状态。当检验点功能缺失且复制胁迫存在时,DNA复制解旋酶CMG复合体仍会前进并解开双链DNA,但前导链复制较滞后链慢,导致前导链暴露出大段单链区域(后续表述称不对称复制)(图3)。这表明检验点激酶Rad53能够协调DNA解旋酶复合体与前导链和后随链复制速度,从而防止大段单链DNA暴露引起的复制叉坍缩及DNA损伤(Molecular Cell,2017)。
上述研究初步揭示了检验点激酶Rad53在受到复制胁迫时对复制体蛋白的调控机制。而由于Rad53在复制检验点通路中处于下游位置,整个复制检验点通路是否参与该调控过程尚不清楚。
本研究中,甘海云团队阐释了DNA复制检验点通路成员对胁迫状态下复制叉状态的影响,发现了检验点通路成员Mec1,Mrc1(哺乳动物中的同源蛋白为Claspin)突变后与Rad53突变体的表型高度一致(不对称复制),表明DNA复制检验点通路是通过Rad53对复制体蛋白进行调控。
此外,Mrc1具有检验点功能,并直接参与DNA复制。Mrc1检验点功能缺失时,细胞响应复制胁迫的表型与Rad53突变体和Mec1突变体一致,而删除Mrc1的复制功能时,不对称复制的表型消失。这暗示Mrc1的复制功能可能是检验点Rad53的调控靶点。根据这一假设,进一步的遗传学实验发现在Rad53突变体中删除Mrc1会使Rad53突变体的不对称分裂表型消失,这一结果初步证实了上述推测。
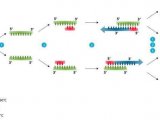
Mrc1是通过与Tof1-Csm3形成复合体来行使其DNA复制功能。那么,Tof1是否也参与这一过程?研究进一步剖析了Tof1突变体表型,证实了Tof1处在这一调控通路中。至此,该研究解析了检验点蛋白是如何在复制胁迫的情况下调节DNA复制的分子机制——细胞感受到复制胁迫后,激活了复制检验点通路Mec1 à Mrc1 à Rad53,激活后的Rad53则通过调节Mrc1-Tof1来实现对前导链和后随链的复制协调以防止出现单链DNA造成基因组不稳定(图4)。
研究工作得到国家自然科学基金重大项目、广东省合成基因组学重点实验室以及深圳合成生物学创新研究院的支持。美国哥伦比亚大学科研人员参与该研究。
论文链接:https://www.pnas.org/content/118/38/e2109334118
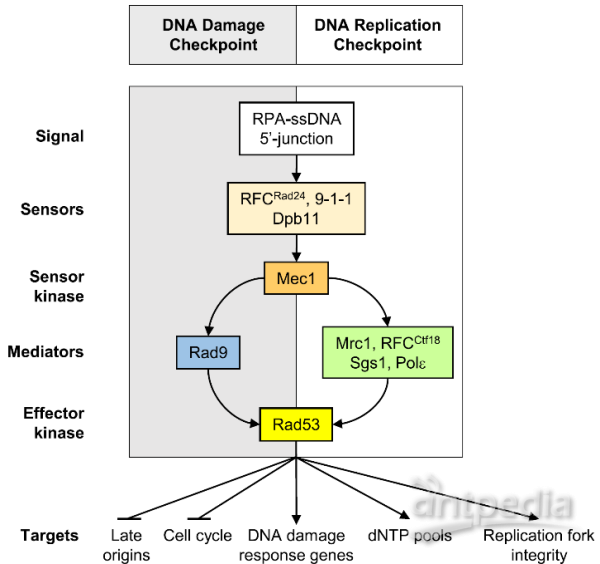
图1.DNA损伤检验点通路与DNA复制检验点通路示意(FEMS Yeast Research,2016)

图2.酿酒酵母中的eSPAN技术实验流程

图3.检验点通路通过RAD53来防止复制胁迫时前导链暴露出大段单链DNA区域

图4.响应复制胁迫时,复制检验点通过Mrc1来实现对前导链与后随链复制的调节